题目内容
18.碳酸氢钠的电离方程式NaHCO3═Na++HCO3-.分析 碳酸氢钠为强电解质,完全电离出钠离子和碳酸氢根离子,碳酸氢根离子为多元弱酸的酸式根离子,不能拆.
解答 解:碳酸氢钠为强电解质,完全电离出钠离子和碳酸氢根离子,电离方程式:NaHCO3═Na++HCO3-,
故答案为:NaHCO3═Na++HCO3-.
点评 本题考查了电解质电离方程式的书写,明确电解质强弱及电离方式是解题关键,注意弱酸的酸式根离子不能拆,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.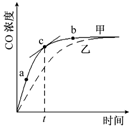 已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )
已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )
 已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )
已知反应Al2O3(s)+3C(s)+N2(g)?2AlN(s)+3CO(g)在温度、容积恒定的密闭容器中进行,其中CO浓度随时间的变化关系如图曲线甲所示.下列说法不正确的是( )| A. | 从a、b两点坐标可求得从a到b时间间隔内该化学反应的平均速率 | |
| B. | c点切线的斜率表示该化学反应在t时刻的瞬时速率 | |
| C. | 在不同时刻都存在关系:3v(N2)=v(CO) | |
| D. | 维持温度、容积不变,若减少N2的物质的量进行反应,曲线甲将转变为曲线乙 |
13.下列化学反应的离子方程式正确的是( )
| A. | 用小苏打(NaHCO3)治疗胃酸过多:HCO3-+H+═CO2↑+H2O | |
| B. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| C. | 碳酸钠溶液与石灰乳的反应:CO32-+Ca2+═CaCO3↓ | |
| D. | 向Ba(OH)2溶液中加入少量的NaHSO4溶液2 H++SO42-+Ba2++2OH-=BaSO4↓+SO42-+2H2O |
3.镍是重要的有色金属之一,但粗镍中一般含有Fe、Cu及难与酸、碱溶液反应的不溶性杂质而影响使用.现对粗镍进行提纯,具体的反应流程如下:
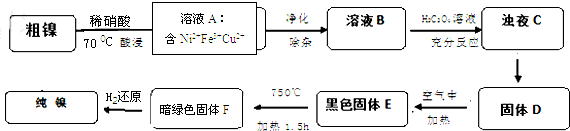
已知:
①2Ni2O3(黑色)$\frac{\underline{\;750℃\;}}{\;}$4NiO(黑色)+O2↑
②
根据信息回答:
(1)28Ni在周期表中的第四周期;镍与稀硝酸反应的离子方程式为3Ni+8H++2NO3-=3Ni2++2NO↑+4H2O.实验表明镍的浸出率与温度有关,随着温度升高镍的浸出率增大,但当温度高于70℃时,镍的浸出率又降低,浸出渣中Ni(OH)2含量增大,其原因为温度升高时,Ni2+的水解程度变大;
(2)在溶液A的净化除杂中,先调节PH=5.5,加热煮沸5min,静置一段时间后,过滤出Fe(OH)3.为了得到纯净的溶液B还需要加入以下物质C进行除杂(填正确答案标号).
A、NaOH B、Na2S C、H2S D、NH3﹒H2O
(3)已知以下三种物质的溶解度关系:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O.由浊液C得到固体D的操作包括过滤、洗涤、干燥(填操作名称); D生成E的化学方程式为4NiC2O4•2H2O+3 O2=2Ni2O3+8CO2↑+8H2O.
(4)1molE经上述流程得到纯镍,理论上参加反应的氢气为2 mol.
(5)测定样品中的镍含量的基本思路是将Ni2+转化为沉淀,通过测量沉淀的质量进一步推算Ni含量.已知Ni2+能与CO32-,C2O42-、S2-等离子形成沉淀,但测定时常选用丁二酮肟(C4H8N2O2)作沉淀剂,生成分子式为C8H14N4O4Ni的鲜红色沉淀.从实验误差角度分析主要原因为:生成沉淀质量大,称量误差小,分析结果准确度高.

已知:
①2Ni2O3(黑色)$\frac{\underline{\;750℃\;}}{\;}$4NiO(黑色)+O2↑
②
| 物质 | CuS | Cu(OH)2 | Ni(OH)2 | NiS |
| Ksp | 8.8×10-38 | 2.2×10-20 | 5.48×10-18 | 3.2×1018 |
(1)28Ni在周期表中的第四周期;镍与稀硝酸反应的离子方程式为3Ni+8H++2NO3-=3Ni2++2NO↑+4H2O.实验表明镍的浸出率与温度有关,随着温度升高镍的浸出率增大,但当温度高于70℃时,镍的浸出率又降低,浸出渣中Ni(OH)2含量增大,其原因为温度升高时,Ni2+的水解程度变大;
(2)在溶液A的净化除杂中,先调节PH=5.5,加热煮沸5min,静置一段时间后,过滤出Fe(OH)3.为了得到纯净的溶液B还需要加入以下物质C进行除杂(填正确答案标号).
A、NaOH B、Na2S C、H2S D、NH3﹒H2O
(3)已知以下三种物质的溶解度关系:NiC2O4>NiC2O4•H2O>NiC2O4•2H2O.由浊液C得到固体D的操作包括过滤、洗涤、干燥(填操作名称); D生成E的化学方程式为4NiC2O4•2H2O+3 O2=2Ni2O3+8CO2↑+8H2O.
(4)1molE经上述流程得到纯镍,理论上参加反应的氢气为2 mol.
(5)测定样品中的镍含量的基本思路是将Ni2+转化为沉淀,通过测量沉淀的质量进一步推算Ni含量.已知Ni2+能与CO32-,C2O42-、S2-等离子形成沉淀,但测定时常选用丁二酮肟(C4H8N2O2)作沉淀剂,生成分子式为C8H14N4O4Ni的鲜红色沉淀.从实验误差角度分析主要原因为:生成沉淀质量大,称量误差小,分析结果准确度高.
10.下列第ⅦA族元素中,非金属性最强的是( )
| A. | 氟 | B. | 氯 | C. | 溴 | D. | 碘 |
8.向含2mol NaOH、1mol Ba(OH)2、2mol Na[Al(OH)4]的混合溶液中慢慢通入CO2,则通入CO2的量和生成沉淀的量的关系不正确的是( )
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 6 |
| n(沉淀)(mol) | 1 | 2 | 3 | 2 |
| A. | A | B. | B | C. | C | D. | D |
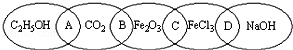 如图为五个椭圆交叉构成的图案,椭圆内分别写C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题:
如图为五个椭圆交叉构成的图案,椭圆内分别写C2H5OH、CO2、Fe2O3、FeCl3和NaOH五种物质,图中相连的两种物质均可归为一类,相交的部分A、B、C、D为其相应的分类标准代号.请回答下列问题: