题目内容
【题目】磷化氢气体(PH3)是一种强烈的储粮害虫杀剂,其制取原理类似于实验室制氨气,空气中磷化氢气体达到2PPM以上时就会造成人畜中毒,请回答:
(1)用碘化磷(PH4I)和烧碱反应制取PH3的化学方程式___________。
(2)实验室用硫酸铜溶液吸收PH3时的化学方程式24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4 ,当吸收2.2molPH3转移电子______mol
(3)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1∶1∶1,写出相应的化学方程式______。
(4)氧硫化碳水解及部分应用流程如下(部分产物已略去):COS![]() H2S
H2S![]() Na2S
Na2S![]() M溶液+H2
M溶液+H2
①组成氧硫化碳和磷化氢的各原子中,原子半径最大的元素在周期表中的位置是_______.
②已知M溶液中硫元素的主要存在形式为S2O32﹣,则反应Ⅲ中生成S2O32﹣的离子方程式为________.
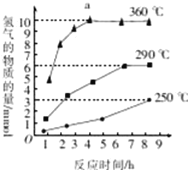
③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mmol),由图象分析可知,a点时M溶液中除S2O32—外,还有____(填含硫微粒的离子符号)。
【答案】PH4I+NaOH![]() PH3↑+NaI+H2O 4.8 KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑ 第三周期第VA族 2S2﹣+5H2O
PH3↑+NaI+H2O 4.8 KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑ 第三周期第VA族 2S2﹣+5H2O![]() S2O32﹣+4H2↑+2OH﹣ SO42﹣
S2O32﹣+4H2↑+2OH﹣ SO42﹣
【解析】
可结合NH4Cl与NaOH加热反应制取NH3,用PH4I与NaOH反应制取PH3;
(2)根据氧化还原反应规律分析判断;
(3)根据题干确定生成物,然后结合原子守恒及物质的物质的量关系书写反应方程式;
(4)①根据物质含有的元素种类,结合元素周期律分析判断;
②依据题干信息:S2-与H2O反应产生S2O32-和H2,结合电荷守恒及原子守恒书写反应式;
③根据反应III在不同温度下反应时间与H2产量关系分析判断。
(1)用PH4I与NaOH加热发生反应产生NaI、H2O、PH3,反应方程式为PH4I+NaOH![]() PH3↑+NaI+H2O;
PH3↑+NaI+H2O;
(2)在反应24CuSO4+11PH3+12H2O=8Cu3P↓+3H3PO4+24H2SO4中,Cu元素的化合价由反应前CuSO4中的+2价变为反应后中Cu3P的+1价,化合价降低,因此CuSO4为氧化剂;每24mol CuSO4发生反应,同时会消耗11molPH3,转移24mol电子,则吸收2.2molPH3转移电子的物质的量为![]() mol=4.8mol;
mol=4.8mol;
(3)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂,粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐KHSO4、NH4HSO4,生成物的物质的量之比为1∶1∶1,反应方程式为:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑;
(4)①组成氧硫化碳和磷化氢的原子为O、S、P、H,由于原子核外电子层数越多,原子半径越大;当原子核外电子层数相同时,原子序数越大,原子半径越小,所以这四种元素中,原子半径最大的元素为P,其在周期表中的位置位于第三周期第VA族;
②S2-与H2O反应产生S2O32-和H2,根据电荷守恒、原子守恒、电子守恒,可得反应方程式为:2S2﹣+5H2O![]() S2O32﹣+4H2↑+2OH﹣;
S2O32﹣+4H2↑+2OH﹣;
③反应III中,a点360℃时,随着时间推移,氢气的物质的量不变,Na2S初始含量为3mmol,若只发生反应2S2﹣+5H2O![]() S2O32﹣+4H2↑+2OH﹣,生成氢气的物质的量为3mmol×
S2O32﹣+4H2↑+2OH﹣,生成氢气的物质的量为3mmol×![]() =6mmol,图示为9mmol,说明M溶液中除含有S2O32﹣外,还含有SO42-,反应方程式为:S2﹣+4H2O=SO42-+4H2↑。
=6mmol,图示为9mmol,说明M溶液中除含有S2O32﹣外,还含有SO42-,反应方程式为:S2﹣+4H2O=SO42-+4H2↑。

 阅读快车系列答案
阅读快车系列答案【题目】如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极。电解过程中,电极b和d上
没有气体逸出,但质量均增大,且增重b>d。符合上述实验结果的盐溶液是

选项 | X | Y |
A | MgSO4 | CuSO4 |
B | AgNO3 | Pb(NO3)2 |
C | FeSO4 | Al2 (SO4)3 |
D | CuSO4 | AgNO3 |
A. A B. B C. C D. D
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下:

已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+、Ca2+和Mg2+。②Cr2O72-+H2O![]() 2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
2CrO42-+2H+。③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe2+ | Mg2+ | Al3+ | Cr3+ |
沉淀完全时的pH | 3.2 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
(1) 实验室用18.4mol/L的浓硫酸配制480mL2mol/L的硫酸,需量取浓硫酸_____mL;配制时除量筒、烧杯和玻璃棒外,还需用到的玻璃仪器有______________。
(2) H2O2的作用是将滤液I中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:__________。
(3过滤II操作得到的滤渣主要为______(填化学式),滤液II中含有的离子主要有__。
(4) 钠离子交换树脂的反应原理为:Mn++nNaR=MRn+nNa+,则利用钠离子交换树脂可除去滤液II中的金属阳离子有_______________。
(5) 写出上述流程中用SO2进行还原时发生反应的离子方程式__________。
【题目】下表中有关物质用途、性质的叙述均正确,且有因果关系的是( )
选项 | 用途 | 性质 |
A | 钠钾合金用作原子反应堆的导热剂 | 钠化学性质很活泼 |
B | KI可用于制作加碘盐 | I﹣具有还原性,易被氧化为I2 |
C | 84消毒液用于环境消毒 | NaClO与H2O、CO2反应生成HClO |
D | Na2CO3用作食品膨松剂 | Na2CO3遇酸能产生气体 |
A.AB.BC.CD.D