题目内容
【题目】碘化钠可用作碘的助溶剂,是制备碘化物的原料。化学实验小组用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠。
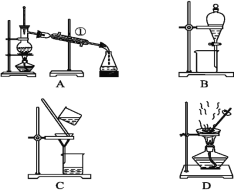
已知:①水合肼(N2H4·H2O)的沸点118℃,100℃开始分解;具有强还原性。②I-、IO3-在碱性条件下共存,酸性条件下反应生成I2。化学实验小组用下图所示装置制备碘化钠,实验步骤如下:
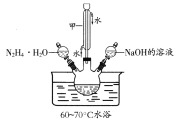
Ⅰ.制备水合肼:用:NaC1O氧化NH3制得水合肼,并将所得溶液装入上述装置左侧分液漏斗。
Ⅱ.向三颈烧瓶中加入一定量单质碘,打开右侧分液漏斗活塞,加入足量NaOH溶液,保持60~70℃水浴,充分反应得到NaI和NaIO3的混合溶液。
Ⅲ.打开左侧分液漏斗活塞,将水合肼溶液加入三颈瓶,并保持60~70℃水浴至反应充分。
Ⅳ.向Ⅲ所得溶液中加入适量活性炭,煮沸半小时,过滤,从滤液中分离出产品。
回答下列问题:
(1)仪器甲的名称是________________。
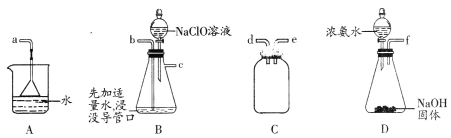
(2)用下图所示装置制备水合肼:
①仪器的接口依次连接的合理顺序是________________________(用字母表示)。
②实验过程中,需要缓慢滴加NaC1O溶液的主要原因是____________________________。
(3)步骤Ⅲ中温度保持在70℃以下的原因是_______________________________________。
(4)步骤Ⅳ中分离出产品的操作是_____________________、洗涤、干燥。
(5)设计方案检验步骤Ⅲ所得溶液中含有NaIO3:__________________________________。
【答案】直型冷凝管 fdebca(或fedbca) 防止过量的NAClO将水合肼氧化 防止NH3H2O分解 蒸发浓缩,冷却结晶,过滤 取少量Ⅲ中所得液体于试管中,先加入稀硫酸酸化,再加淀粉,淀粉变蓝,证明NaI3O存在
【解析】
实验目的为用NaOH、单质碘和水合肼(N2H4·H2O)为原料制备碘化钠,利用水合肼的强还原性,与碘和NaOH反应生成的NaIO3反应,得到纯净的碘化钠。
(1)仪器甲的名称是直型冷凝管;
(2) ①用NaC1O氧化NH3制得水合肼,装置D为制备氨气,装置B为NaC1O氧化氨气的装置,装置C为安全瓶,装置A为防倒吸装置,则制取的氨气经由安全瓶,进入装置B,从c口进入装置A,则连接顺序为fdebca(或fedbca);
②水合肼(N2H4·H2O)具有强还原性,若滴加NaC1O溶液过快,导致溶液中NaC1O的量较多,氧化水合肼;
(3)已知水合肼(N2H4·H2O)的沸点118℃,100℃开始分解,为减少水合肼的分解,则控制温度在70℃以下;
(4) 步骤III中水合肼与碘酸根离子反应生成碘离子和氮气,得到碘化钠溶液,则步骤Ⅳ先对溶液进行浓缩,再进行降温结晶,再过滤、洗涤、干燥即可;
(5) 已知I-、IO3-酸性条件下反应生成I2,步骤Ⅲ所得溶液中含有NaI,可加入稀硫酸使其生成碘单质,再进行验证,方案为取少量Ⅲ中所得液体于试管中,先加入稀硫酸酸化,再加淀粉,淀粉变蓝,证明NaIO3存在。