题目内容
13.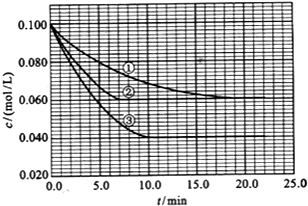 在溶液中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:
在溶液中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:(1)与①比较,②和③分别仅改变一种反应条件.所改变的条件和判断的理由是:②加入催化剂③增大压强
(2)实验②平衡时B的转化率为40%;实验③平衡时C的浓度为0.060mol/L;
(3)该反应进行到4.0min时的平均反应速度率:实验②:vB=0.014mol(L•min)-1;实验③:vC=0.009mol(L•min)-1.
分析 (1)该反应是一个反应前后气体计量数之和减小的可逆反应,与①比较,平衡时②中A的浓度不变、反应时间缩短,说明反应速率增大平衡不移动,则改变条件是加入催化剂;
平衡时③中A的浓度降低,说明平衡向右移动,且反应到达平衡时间缩短,则反应速率增大,应该是改变压强;
(2)实验②中参加反应的△c(A)=(0.100-0.060)mol/L=0.040mol/L,根据方程式知,参加反应的△c(B)=2
△c(A)=0.080mol/L,转化率=$\frac{参加反应的浓度变化量}{反应初始浓度}×100%$;
根据方程式知,参加反应的△c(C)=△c(A)=(0.100-0.040)mol/L=0.060mol/L;
(3)实验②中,vA=$\frac{0.100mol/L-0.072mol/L}{4min}$=0.007mol(L•min)-1,根据vB=2vA计算;
实验③中,vA=$\frac{0.100mol/L-0.064mol/L}{4min}$=0.009mol(L•min)-1,根据vC=vA计算.
解答 解:(1)该反应是一个反应前后气体计量数之和减小的可逆反应,与①比较,平衡时②中A的浓度不变、反应时间缩短,说明反应速率增大平衡不移动,则改变条件是加入催化剂;
平衡时③中A的浓度降低,说明平衡向右移动,且反应到达平衡时间缩短,则反应速率增大,应该是增大压强,
故答案为:加入催化剂;增大压强;
(2)实验②中参加反应的△c(A)=(0.100-0.060)mol/L=0.040mol/L,根据方程式知,参加反应的△c(B)=2
△c(A)=0.080mol/L,转化率=$\frac{参加反应的浓度变化量}{反应初始浓度}×100%$=$\frac{0.080mol/L}{0.200mol/L}×100%$=40%;
根据方程式知,参加反应的△c(C)=△c(A)=(0.100-0.040)mol/L=0.060mol/L,
故答案为:40%;0.060mol/L;
(3)实验②中,vA=$\frac{0.100mol/L-0.072mol/L}{4min}$=0.007mol(L•min)-1,所以vB=2vA=0.014mol(L•min)-1;
实验③中,vA=$\frac{0.100mol/L-0.064mol/L}{4min}$=0.009mol(L•min)-1,所以vC=vA=0.009mol(L•min)-1,
故答案为:0.014mol(L•min)≠<-1;0.009mol(L•min)-1.
点评 本题考查化学平衡计算及化学平衡影响因素,侧重考查分析计算能力,明确方程式中各个物理量关系是解本题关键,知道常见影响平衡移动、化学反应速率的因素,难点是图象分析,题目难度中等.

 同步奥数系列答案
同步奥数系列答案| A. | 碳酸氢钠溶液中滴入苯酚的水溶液后不会放出二氧化碳 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 其水溶液显强酸性,俗称石炭酸 |
| A. | 一 | B. | 二 | C. | 三 | D. | 四 |
| A. | Al(OH)3→Al2O3 | B. | Al2O3→Al(OH)3 | C. | Al→Al(OH)3 | D. | SiO2→H2SiO3 |
| A. | CCl4、SiCl4、SiH4 | B. | H2S、NF3、CH4 | ||
| C. | BCl3、CH2═CHCl、环己烷 | D. | SO3、C6H6(苯)、CH3C≡CH |
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物 | |
| B. | PM2.5只是地球大气成分中含量很少的组分,对空气质量和能见度等没什么影响 | |
| C. | PM2.5粒径小,富含大量的有毒、有害物质且在大气中的停留时间长、输送距离远 | |
| D. | PM2.5主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物等 |
| A. | Ba2+、AlO2-、NO3-、Cl- | B. | K+、Na+、ClO-、Fe2+ | ||
| C. | Na+、I-、NO3-、SO42- | D. | NH4+、Na+、S2-、CO32- |
| A. | 苯不能使酸性高锰酸钾溶液褪色,所以苯不能发生氧化反应 | |
| B. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 | |
| C. | 丙烯分子中所有原子不可能在同一平面上 | |
| D. | 蛋白质、糖类、油脂均能发生水解反应 |
 K2S
K2S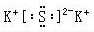 NaOH
NaOH
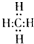 ,分子里各原子的空间分布呈正四面体结构.分子式为C4Hm的烷烃,m值等于10;并写出它的同分异构体的结构简式CH3CH2CH2CH3、(CH3)2CHCH3.
,分子里各原子的空间分布呈正四面体结构.分子式为C4Hm的烷烃,m值等于10;并写出它的同分异构体的结构简式CH3CH2CH2CH3、(CH3)2CHCH3.