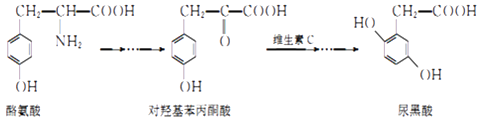
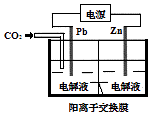
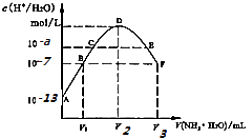
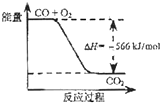
题目内容
【题目】常温下,将10mL pH=1的CH3COOH溶液加水稀释至100mL后,溶液中的pH值为( )
A.2
B.2<pH<7
C.1<pH<2
D.无法判读
【答案】C
【解析】解:CH3COOH为弱酸,加水稀释时醋酸还要电离生成氢离子,pH=1的CH3COOH溶液中氢离子浓度为0.1mol/L,稀释至100mL后,醋酸的电离程度增大,则溶液中氢离子浓度大于:0.1mol/L× ![]() =0.01mol/L,所以稀释后的溶液的pH小于:﹣lg0.01=2;加水稀释氢离子浓度减小,则pH变大,所以稀释后的溶液的pH>1,
=0.01mol/L,所以稀释后的溶液的pH小于:﹣lg0.01=2;加水稀释氢离子浓度减小,则pH变大,所以稀释后的溶液的pH>1,
综上可知,稀释后的醋酸溶液:1<pH<2;
故选C.
【考点精析】本题主要考查了弱电解质在水溶液中的电离平衡的相关知识点,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理才能正确解答此题.

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=;若其他条件不变,容器体积缩小为1L,则K值 . (增大、减小或不变);若K300°C>K350°C , 则该反应是热反应.
(2)用O2表示从0~2s内该反应的平均速率v=;
(3)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.