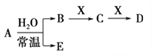题目内容
【题目】某溶液中可能含有下列5种离子中的某几种:Na+、NH4+、Mg2+、Al3+、Clˉ.为确认该溶液组成进行如下实验:①取20.0mL该溶液,加入25.0mL 4.00molL-1NaOH溶液,有白色沉淀、无剌激气味气体生成.过滤、洗涤、干燥,得沉淀1.16g.再将滤液稀释至100mL,测得滤液中c(OHˉ)为0.20molL-1;②另取20.0mL该溶液,加入足量的AgNO3溶液,生成白色沉淀11.48g.由此可得出关于原溶液组成的正确结论是
A.一定含有Mg2+、Al3+、Clˉ,不含Na+、NH4+
B.一定含有Na+、Mg2+、Clˉ,不含NH4+,可能含有Al3+
C.c(Clˉ)为 4.00molL-1,c(Al3+)为1.00 molL-1
D.c(Mg2+)为 1.00molL-1,c(Na+)为 0.50 molL-1
【答案】D
【解析】
试题分析:①25.0mL 4.00molL-1NaOH溶液,含有0.1mol氢氧化钠;沉淀1.16g为氢氧化镁,物质的量是0.02mol,生成沉淀消耗0.04mol氢氧化钠;滤液中的n(OH-)=0.2molL-1×0.1L=0.02mol,故还有0.04mol氢氧化钠和0.01molAl3+反应生成了偏铝酸钠,故一定含有Mg2+、Al3+;无刺激气味气体生成,一定没有NH4+;②白色沉淀11.48g是氯化银,物质的量是:![]() =0.08mol,则一定含有氯离子,根据电荷守恒,正电荷有:(0.02mol×2+0.01mol×3)=0.07mol;负电荷有:0.08mol,故一定含有钠离子0.01mol。A、根据以上分析可知,溶液中一定存在:Na+、Mg2+、Al3+、Cl-,由于一定含有Na+,故A错误;B、溶液中一定存在:Na+、Mg2+、Al3+、Cl-,即一定含有Al3+,故B错误;C、c(Al3+)=
=0.08mol,则一定含有氯离子,根据电荷守恒,正电荷有:(0.02mol×2+0.01mol×3)=0.07mol;负电荷有:0.08mol,故一定含有钠离子0.01mol。A、根据以上分析可知,溶液中一定存在:Na+、Mg2+、Al3+、Cl-,由于一定含有Na+,故A错误;B、溶液中一定存在:Na+、Mg2+、Al3+、Cl-,即一定含有Al3+,故B错误;C、c(Al3+)=![]() =0.5 molL-1,c(Cl-)=
=0.5 molL-1,c(Cl-)=![]() =4mol/L,故C错误;D、c(Mg2+)=
=4mol/L,故C错误;D、c(Mg2+)=![]() =1.00 molL-1,c(Na+) =
=1.00 molL-1,c(Na+) =![]() =0.50 molL-1,故D正确;故选D。
=0.50 molL-1,故D正确;故选D。

【题目】80℃时,NO2(g)+SO2(g)![]() SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
SO3(g)+ NO (g)。该温度下,在甲、乙、丙三个体积相等且恒容的密闭容器中,投入NO2和SO2,起始浓度如下表所示,其中甲经2min达平衡时,NO2的转化率为50%,下列说法正确的是
起始浓度 | 甲 | 乙 | 丙 |
c(NO2)/mol L-1 | 0.10 | 0.20 | 0.20 |
C(SO2)/ mol L-1 | 0.10 | 0.10 | 0.20 |
A. 容器甲中的反应在前2 min的平均速率v(SO2)=0.05 mol L-1 min-1
B. 达到平衡时,容器丙中正反应速率与容器甲相等
C. 温度升至90℃,上述反应平衡常数为1.56,则反应的△H>0
D. 容器乙中若起始时改充0.10 molL-1 NO2和0.20molL-1 SO2,达到平衡时c(NO)与原平衡相同