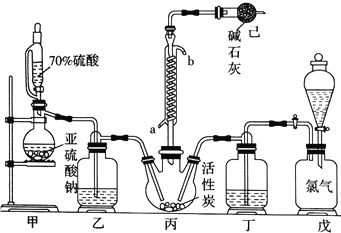
题目内容
【题目】苏州工匠用白铜打造的食蟹工具“蟹八件”,主要成分是铜镍合金。Ni能与CO形成正四面体形的配合物Ni(CO)4,CuSO4溶于氨水形成[Cu(NH3)4]SO4深蓝色溶液。
(1)Cu基态原子核外电子排布式为________________。
(2)1 mol Ni(CO)4中含有σ键的数目为_______________。
(3)[Cu(NH3)4]SO4中阴离子的空间构型是___________,与SO42-互为等电子体的分子为_______________。(填化学式)
(4) NH3的沸点_______________。(选填“高于”或“低于”)PH3,原因是_______________。
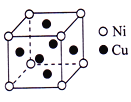
(5)某白铜合金晶胞结构如右图所示.晶胞中铜原子与镍原子的个数比为_______________。
【答案】 ls22s22p63s23p63d104s1 或[Ar]3d104s1 8mol或8×6.02×1023 正四面体 CCl4 高于 NH3分子间存在氢键 3∶1
【解析】(1)Cu的核电荷数为29,其基态原子核外电子排布式为ls22s22p63s23p63d104s1 或[Ar]3d104s1;
(2) Ni(CO)4中C和O间存在σ键,Ni和C间存在σ键,1mol Ni(CO)4中含σ键数目为1×4+4=8mol;
(3)SO42一离子中含有4个δ键,孤电子对数=![]() =0,所以SO42一为正四面体结构,离子含有5的原子,价电子总数为32,对应的等电子体有CCl4、CF4;
=0,所以SO42一为正四面体结构,离子含有5的原子,价电子总数为32,对应的等电子体有CCl4、CF4;
(4) NH3分子间存在氢键,导致其沸点高于PH3;
(5)晶胞中Ni处于顶点,Cu处于面心,则晶胞中Ni原子数目为8×![]() =1、Cu原子数目=6×
=1、Cu原子数目=6×![]() =3,故Cu与Ni原子数目之比为3︰1。
=3,故Cu与Ni原子数目之比为3︰1。

练习册系列答案
相关题目