题目内容
17.已知X+、Y2+、Z-、W2-四种离子具有相同的电子层结构.下列关于X、Y、Z、W四种元素的描述,不正确的是( )| A. | 金属性:X>Y,还原性:Z->W2- | B. | 原子半径:X>Y>W>Z | ||
| C. | 离子半径:Y2+<X+<Z-<W2- | D. | 原子序数:Y>X>Z>W |
分析 X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,则X、Y处于同一周期,原子序数Y>X;Z、W处于同一周期,且处于X、Y所在周期上一周期,原子序数Z>W,所以原子序数Y>X>Z>W,由离子所带电荷可知,X、Y为金属元素,而Z、W为非金属元素,再根据元素周期律递变规律判断.
解答 解:X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,则X、Y处于同一周期,原子序数Y>X;Z、W处于同一周期,且处于X、Y所在周期上一周期,原子序数Z>W,所以原子序数Y>X>Z>W,由离子所带电荷可知,X、Y为金属元素,而Z、W为非金属元素.
A.X、Y处于同一周期,形成阳离子,原子序数Y>X,所以金属性:X>Y;Z、W处于同一周期,形成阴离子,原子序数Z>W,所以非金属性Z>W,非金属性越强,阴离子还原性越弱,所以还原性:W2->Z-,故A错误;
B.Z、W处于同一周期,且处于X、Y所在周期上一周期,原子序数Y>X>Z>W,同周期元素原子序数越大,半径越小,所以原子半径X>Y,W>Z,原子核外电子层数越多,半径越大,所以X>Y>W>Z,故B正确;
C.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:Y2+<X+<Z-<W2-,故C正确;
D.X+、Y2+、Z-、W2-四种离子具有相同的电子层结构,所以原子序数Y>X>Z>W,故D正确;
故选:A.
点评 本题考查位置结构性质的相互关系及应用,根据核外电子结构相同确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,难度不大.

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目
7.下列溶液中溶质的物质的量浓度为1mol•L-1的是( )
| A. | 将40g NaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 将25g硫酸铜晶体溶于水制成100mL的溶液 | |
| C. | 将1L 10mol/L的浓盐酸与9L水混合而成的溶液 | |
| D. | 从100mL 1mol/L NaCl溶液加水稀释到200mL的溶液 |
8.利用右图所示装置进行下列实验,不能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 | 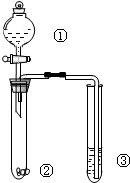 |
| A | 浓盐酸 | KMnO4 | NaBr溶液 | 氧化性:KMnO4>Cl2>Br2 | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
| D | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硫酸>碳酸>硅酸 |
| A. | A | B. | B | C. | C | D. | D |
5.下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②pH=1的强酸溶液,加水稀释后,溶液中所有离子浓度都降低
③反应4A (g)+B(g)═2C(g)+D(g)不能自发进行,则该反应△H一定小于0
④溶液、胶体、浊液三种分散系可用丁达尔效应进行区分
⑤熔融的电解质都能导电
⑥勒夏特列原理用于判断可逆反应是否达到平衡状态.
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②pH=1的强酸溶液,加水稀释后,溶液中所有离子浓度都降低
③反应4A (g)+B(g)═2C(g)+D(g)不能自发进行,则该反应△H一定小于0
④溶液、胶体、浊液三种分散系可用丁达尔效应进行区分
⑤熔融的电解质都能导电
⑥勒夏特列原理用于判断可逆反应是否达到平衡状态.
| A. | ①③⑤⑥ | B. | ②④⑤⑥ | C. | 只有⑤ | D. | 均不对 |
12. 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).
(1)判断反应达到平衡状态的依据是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K=$\frac{c(CH{\;}_{3}OH)}{c(CO)c{\;}^{2}(H{\;}_{2})}$,△H<0(填“>”、“<”或“=”).
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
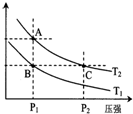
(3)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-akJ•mol-1;②2CO(g)+O2(g)═2CO2(g)△H=-bkJ•mol-1;③H2O(g)═H2O(l)△H=-ckJ•mol-1.写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$kJ•mol-1.
 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)═CH3OH(g).(1)判断反应达到平衡状态的依据是cd(填序号).
a.生成CH3OH的速率与消耗CO的速率相等 b.混合气体的密度不变
c.混合气体的平均相对分子质量不变 d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
②要提高CO的转化率,可以采取的措施是df(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(3)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A<C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A=C,由状态B到状态A,可采用升温的方法(填“升温”或“降温”).
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-akJ•mol-1;②2CO(g)+O2(g)═2CO2(g)△H=-bkJ•mol-1;③H2O(g)═H2O(l)△H=-ckJ•mol-1.写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=$\frac{b-a-4c}{2}$kJ•mol-1.
2.质量为9.7g 的Cu、Zn合金与足量的稀HNO3反应,还原产物只有NO气体,其体积在标准状况下为2.24L,将溶液稀释为1L,测得溶液的pH=1,此时溶液中NO3-的浓度为( )
| A. | 0.3 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.5 mol•L-1 | D. | 0.6 mol•L-1 |
9.碘是一种易溶于酒精,苯,汽油,四氯化碳的物质,现有碘的水溶液,要从碘水中萃取出碘,下列试剂不能用作萃取剂的是( )
| A. | 四氯化碳 | B. | 汽油 | C. | 酒精 | D. | 苯 |
6.完全燃烧一定量的无水乙醇(C2H5OH),放出的热量为Q,用6mol/L的NaOH溶液吸收燃烧放出的CO2,消耗50mL时,生成等物质的量的Na2CO3和NaHCO3.则燃烧1mol无水乙醇时放出的热量为( )
| A. | 0.2Q | B. | 0.1Q | C. | 5Q | D. | 10Q |
7.在标准状况下,a mol气体A分子与b mol气体B分子的质量相同.则与此有关的下列说法中正确的是( )
| A. | A与B的摩尔质量之比为a:b | |
| B. | 相同状况下,同体积的A与B的质量之比为a:b | |
| C. | 质量相同的A与B的体积之比为b:a | |
| D. | 同温同压下,A与B的密度之比为b:a |