题目内容
19.室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$不变 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mL pH=11的NaOH溶液,混合液pH=7 |
分析 醋酸是弱电解质,CH3COOH?CH3COO-+H+,电离平衡常数的大小只受温度影响,室温下向10mLpH=3的醋酸溶液中加水稀释将促进电离,离子的数目增多,但溶液的体积增大,则电离产生的离子的浓度减小,并利用酸碱混合时pH的计算来解答.
解答 解:A.弱电解质,浓度越稀,电离程度越大,醋酸溶液中加水稀释,促进电离,溶液中导电粒子的数目增多,故A错误;
B.醋酸的电离平衡常数Ka=$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$,温度不变,Ka不变,则不变,故B正确;
C.醋酸溶液中加水稀释,醋酸的电离程度增大,因溶液的体积增大的倍数大于n(H+)增加的倍数,则c(H+)减小,酸性减弱,故C错误;
D.等体积10mLpH=3的醋酸与pH=11的NaOH溶液混合时,醋酸的浓度大于0.001mol/L,醋酸过量,则溶液的pH<7,故D错误;
故选B.
点评 本题考查了弱电解质的稀释,明确温度与电离平衡常数的关系、溶液的pH与物质的量浓度的关系、稀释中溶液体积的变化与离子的物质的量的变化关系是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
7.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O$\stackrel{放电充电}{?}$Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
| A. | 放电时电解质溶液中的OH-向正极移动 | |
| B. | 充电过程是化学能转化为电能的过程 | |
| C. | 放电时电子从正极经过外线路流向负极 | |
| D. | 充电时Ni(OH)2在阴极失电子 |
11.下列有关有机物的叙述正确的是( )
| A. | 由乙烯与氧气在Ag作催化剂下反应制取环氧乙烷原子利用率可达100% | |
| B. | 高聚物的相对分子质量一定为单体相对分子质量的整数倍 | |
| C. |  分子中只存在羧基、羟基两种官能团 分子中只存在羧基、羟基两种官能团 | |
| D. |  分子中至少有14个原子共平面 分子中至少有14个原子共平面 |
9.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温下,18gH2O中含有2NA个氢原子 | |
| B. | 标准状况下,22.4L H2O含有NA个H2O分子 | |
| C. | 1mol Na与足量水反应转移2NA个电子 | |
| D. | 0.1 mol•L-1CH3COOH溶液中含有0.1NA个CH3COO- |
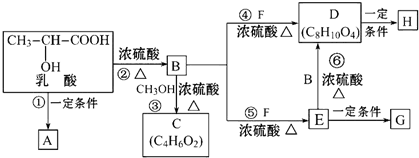
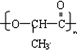 ;
; .
. 超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某
超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某