题目内容
6.0.5 mol Na2CO3中所含的Na+数约为( )| A. | 3.01×1023 | B. | 6.02×1023 | C. | 0.5 | D. | 1 |
分析 根据n=$\frac{N}{{N}_{A}}$结合物质的构成特点解答该题.
解答 解:由物质的构成特点可知,0.5 mol Na2CO3中含有1molNa+,则个数为6.02×1023,
故选B.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力,题目难度不大,注意把握物质的构成特点,为解答该题的关键.

练习册系列答案
相关题目
16.一种甲醇、氧气和强碱溶液作电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH+3O2+4OH-═2CO32-+6H2O,则有关说法正确的是( )
| A. | 放电时,CH3OH参与反应的电极为正极 | |
| B. | 放电时,负极的电极反应为CH3OH+8OH--6e-═CO32-+6H2O | |
| C. | 标准状况下,通入5.6 L O2并完全反应后,有0.5mol电子转移 | |
| D. | 放电一段时间后,通入氧气的电极附近溶液的pH降低 |
17.已知H2(g)+Br2(g)═2HBr(g)△H=-70KJ/mol,其它相关数据如下表:
则表中a为( )
| H2(g) | Br2(g) | HBr(g) | |
| 1mol 分子中的化学键断裂时需要吸收的能量/KJ | 410 | a | 370 |
| A. | 400 | B. | 260 | C. | 230 | D. | 200 |
11.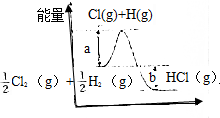 氢气在氯气中燃烧的化学方程式为$\frac{1}{2}$Cl2 (g)+$\frac{1}{2}$H2 (g)═HCl(g),该反应过程中的能量变化如图所示,下列有关叙述正确的是( )
氢气在氯气中燃烧的化学方程式为$\frac{1}{2}$Cl2 (g)+$\frac{1}{2}$H2 (g)═HCl(g),该反应过程中的能量变化如图所示,下列有关叙述正确的是( )
 氢气在氯气中燃烧的化学方程式为$\frac{1}{2}$Cl2 (g)+$\frac{1}{2}$H2 (g)═HCl(g),该反应过程中的能量变化如图所示,下列有关叙述正确的是( )
氢气在氯气中燃烧的化学方程式为$\frac{1}{2}$Cl2 (g)+$\frac{1}{2}$H2 (g)═HCl(g),该反应过程中的能量变化如图所示,下列有关叙述正确的是( )| A. | a代表反应物的总能量 | B. | a+b代表生成物的总能量 | ||
| C. | 该反应为放热反应 | D. | 反应焓变△H=bkJ•mol-1 (b>0) |
7.镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O$\stackrel{放电充电}{?}$Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
| A. | 放电时电解质溶液中的OH-向正极移动 | |
| B. | 充电过程是化学能转化为电能的过程 | |
| C. | 放电时电子从正极经过外线路流向负极 | |
| D. | 充电时Ni(OH)2在阴极失电子 |
5.某种烃与H21:1加成后的产物是(CH3)2CHCH(CH3)C(CH3)3则该烃的结构式可能有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |


 ;
; ;
; .
. 超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某
超细铜粉主要应用于导电材料、催化剂等领域中.超细铜粉的某