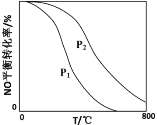
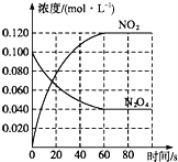
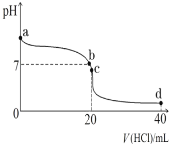
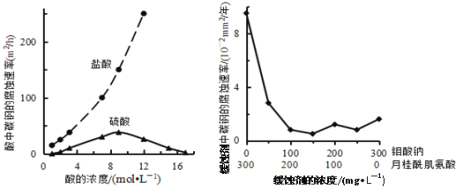
题目内容
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 四种元素,前三种元素的简单离子都和氖原子具有相同的核外电子排布。
四种元素,前三种元素的简单离子都和氖原子具有相同的核外电子排布。![]() 元素没有正化合价;
元素没有正化合价;![]() 的氢化物的分子式为
的氢化物的分子式为![]() ,
,![]() 的
的![]() 的单质能从足量酸溶液中置换出
的单质能从足量酸溶液中置换出![]() (标准状况);
(标准状况);![]() 的原子核中没有中子。
的原子核中没有中子。
(1)根据以上条件,推断![]() 、
、![]() 、
、![]() 、
、![]() 的元素名称。
的元素名称。
A________,B ________,C ________,D ________。
(2)用电子式表示![]() 与
与![]() 、
、![]() 与
与![]() 、
、![]() 与
与![]() 相互结合成的化合物,指出其化合物的类型及所含化学键类型。
相互结合成的化合物,指出其化合物的类型及所含化学键类型。
化合物 | 电子式 | 化合物类型 | 化学键类型 |
| _____ | _____ | _____ |
| _____ | _____ | _____ |
B+D | ____ | _____ | _____ |
(3)写出![]() 与
与![]() 所形成的化合物和
所形成的化合物和![]() 与
与![]() 所形成的化合物反应的离子方程式:_______。
所形成的化合物反应的离子方程式:_______。
【答案】氟 氧 钠 氢 ![]() 离子化合物 离子键
离子化合物 离子键 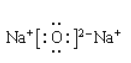 或
或![]() 离子化合物 离子键或离子键和共价键
离子化合物 离子键或离子键和共价键 ![]() 或
或![]() 共价化合物 共价键 Na2O+H2O=2Na++2OH-(或2Na2O2+ 2H2O=4Na++4OH-+O2↑)
共价化合物 共价键 Na2O+H2O=2Na++2OH-(或2Na2O2+ 2H2O=4Na++4OH-+O2↑)
【解析】
![]() 、
、![]() 、
、![]() 的简单离子的结构与氖原子的结构相同,说明
的简单离子的结构与氖原子的结构相同,说明![]() 、
、![]() 、
、![]() 是第二周期的非金属元素或第三周期的金属元素;
是第二周期的非金属元素或第三周期的金属元素;![]() 的氢化物的分子式为
的氢化物的分子式为![]() ,说明
,说明![]() 是氧元素;
是氧元素;![]() 是没有正化合价的元素,说明
是没有正化合价的元素,说明![]() 只能得电子,为氟元素;
只能得电子,为氟元素;![]() 的单质与酸溶液反应能产生
的单质与酸溶液反应能产生![]() ,说明
,说明![]() 为金属元素且在第三周期,再由
为金属元素且在第三周期,再由![]() 的
的![]() 的单质与足量酸溶液反应能产生
的单质与足量酸溶液反应能产生![]() ,说明
,说明![]() 为钠元素;
为钠元素;![]() 的原子核中没有中子,说明
的原子核中没有中子,说明![]() 为氢元素。
为氢元素。
(1)![]() 、
、![]() 、
、![]() 、
、![]() 的元素名称分别为氟 、氧、钠、氢;
的元素名称分别为氟 、氧、钠、氢;
(2)钠和氟形成氟化钠,属于离子化合物,含有离子键,电子式为![]() ;钠和氧形成氧化钠或过氧化钠,都属于离子化合物,氧化钠含有离子键,电子式为:
;钠和氧形成氧化钠或过氧化钠,都属于离子化合物,氧化钠含有离子键,电子式为: 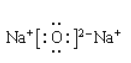 ,过氧化钠中含有离子键和共价键,电子式为:
,过氧化钠中含有离子键和共价键,电子式为: 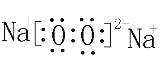 ;氧和氢形成的化合物为水或过氧化氢,属于共价化合物,含有共价键,水的电子式为:
;氧和氢形成的化合物为水或过氧化氢,属于共价化合物,含有共价键,水的电子式为: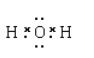 ,过氧化氢的电子式为:
,过氧化氢的电子式为:![]() ;
;
(3)氧化钠与水反应生成氢氧化钠,过氧化钠与水反应生成氢氧化钠和氧气,离子方程式为:Na2O+H2O=2Na++2OH-(或2Na2O2+ 2H2O=4Na++4OH-+O2↑)。

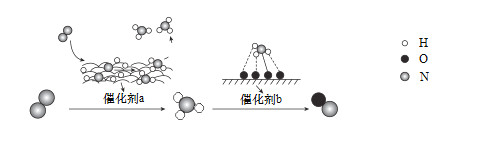
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | KMnO4 | NaOH | 能制取、收集氯气并能吸收尾气 | |
B | 浓氨水 | 生石灰 | 酚酞稀溶液 | 能制取氨气并验证氨气的水溶液呈碱性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可生成白色沉淀 | |
D | 稀硫酸 | Na2CO3 | Na2SiO3溶液 | 非金属性:S>C>Si |
A.AB.BC.CD.D