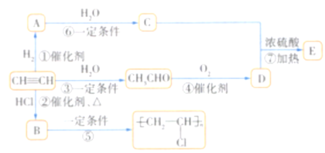
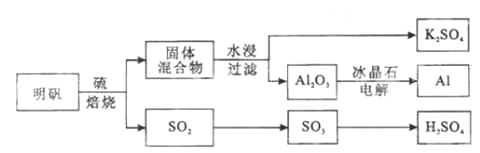
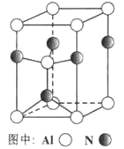
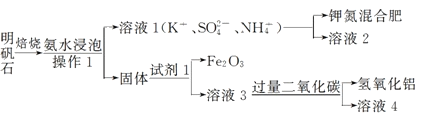
题目内容
【题目】某氮肥厂用NH3经一系列反应制得HNO3。NH3→NO→NO2→HNO3。
(1)25℃时,NH3和O2能反应生成NO和液态水,生成6mol水时放热1289kJ,其热化学方程式是_____。
(2)对于反应2NO(g)+O2(g)![]() 2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
2NO2(g),在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
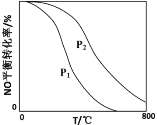
请比较P1、P2的大小:P1____P2(填“>”、“=”或“<”);该反应△H____0(填“>”、“=”或“<”)。
(3)四氧化二氮和二氧化氮可互相转化。在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
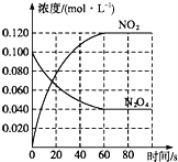
①该反应的△H_____0(填“>”、“=”或“<”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为_____molL-1s-1,该温度下反应的平衡常数K=_____。
②反应达平衡后,将反应容器的容积缩小到原来的一半,平衡向_____(填“正反应”或“逆反应”)方向移动。
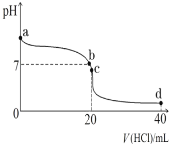
(4)25℃时,将0.1mol·L-1盐酸滴入20mL0.1mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示。
①写出NH3·H2O的电离方程式:_____。
②b点所示溶液中c(Cl-)_____c(NH![]() )(填“>”、“=”或“<”)。
)(填“>”、“=”或“<”)。
③c点所示溶液中,离子浓度由大到小的顺序是_____。
【答案】4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(l) ΔH=-1289kJ/mol < < > 0.001molL-1s-1 0.24 逆反应 NH3·H2O
4NO(g)+6H2O(l) ΔH=-1289kJ/mol < < > 0.001molL-1s-1 0.24 逆反应 NH3·H2O![]() NH4++OH- = c(Cl-)> c(NH4+)> c(H+)> c(OH-)
NH4++OH- = c(Cl-)> c(NH4+)> c(H+)> c(OH-)
【解析】
根据图像和描述判断平衡移动的方向,结合勒夏特列原理,判断反应的热效应,比较压强大小;速率和平衡常数的计算,根据公式和图中给出数据进行计算;b、c两点对应坐标,明确反应情况进行计算,b点为中性溶液,根据电荷守恒得出二者离子浓度相等,c点恰好完全反应,因NH4+水解比较各离子浓度大小。
(1)氨气和氧气在催化剂作用下发生氧化还原反应,生成NO和水,热化学方程为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(l) ΔH=-1289kJ/mol;
4NO(g)+6H2O(l) ΔH=-1289kJ/mol;
(2)①该反应的正反应为气体物质的量减小的反应,其他条件不变时,增大压强,平衡向气体物质的量减小的方向移动,即向正反应方向移动,即压强越高,NO的平衡转化率越大,根据图示知,相同温度下,压强P1时NO的转化率<P2时NO的转化率,故P1<P2;
②其他条件不变时,升高温度,平衡向着吸热反应方向移动,又根据图示知,相同压强下,随着温度的升高,NO的转化率降低,即升高温度,平衡向逆反应方向移动,故逆反应方向为吸热反应,则正反应方向是放热反应,则△H<0;
(3)①N2O4(g)![]() 2NO2(g),N2O4为无色气体,NO2为红棕色气体,随温度升高,混合气体的颜色变深,说明平衡往正反应方向移动,升高温度,平衡向着吸热反应方向移动,故正向为吸热方向,△H>0;由图可知,0~60s,Δc(N2O4)=0.060molL-1,v(N2O4)= Δc(N2O4)/Δt=0.060molL-1/60s=0.001molL-1s-1,平衡常数K= c2(NO2)/c(N2O4)=0.122/0.06=0.24;
2NO2(g),N2O4为无色气体,NO2为红棕色气体,随温度升高,混合气体的颜色变深,说明平衡往正反应方向移动,升高温度,平衡向着吸热反应方向移动,故正向为吸热方向,△H>0;由图可知,0~60s,Δc(N2O4)=0.060molL-1,v(N2O4)= Δc(N2O4)/Δt=0.060molL-1/60s=0.001molL-1s-1,平衡常数K= c2(NO2)/c(N2O4)=0.122/0.06=0.24;
②反应达平衡后,将反应容器的容积缩小到原来的一半,则压强增大,平衡向着气体物质的量减小的方向移动,即逆反应方向移动;
(4)①NH3·H2O为弱电解质,发生部分电离,电离方程式为:NH3·H2O![]() NH4++OH-;
NH4++OH-;
②由图可知,b点pH=7,此温度条件下,溶液呈中性,c(H+)=c(OH-),根据电荷守恒:c(NH4+)+c(H+)=c(Cl-)+c(OH-),得出c(NH4+)=c(Cl-)
③由图可知,c点加入的HCl体积为20mL,二者等浓度等体积混合,恰好完全反应,得到NH4Cl和水,因NH4+水解,故离子浓度由大到小顺序为c(Cl-)> c(NH4+)> c(H+)> c(OH-)。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案【题目】![]() 、
、![]() 、
、![]() 、
、![]() 四种元素,前三种元素的简单离子都和氖原子具有相同的核外电子排布。
四种元素,前三种元素的简单离子都和氖原子具有相同的核外电子排布。![]() 元素没有正化合价;
元素没有正化合价;![]() 的氢化物的分子式为
的氢化物的分子式为![]() ,
,![]() 的
的![]() 的单质能从足量酸溶液中置换出
的单质能从足量酸溶液中置换出![]() (标准状况);
(标准状况);![]() 的原子核中没有中子。
的原子核中没有中子。
(1)根据以上条件,推断![]() 、
、![]() 、
、![]() 、
、![]() 的元素名称。
的元素名称。
A________,B ________,C ________,D ________。
(2)用电子式表示![]() 与
与![]() 、
、![]() 与
与![]() 、
、![]() 与
与![]() 相互结合成的化合物,指出其化合物的类型及所含化学键类型。
相互结合成的化合物,指出其化合物的类型及所含化学键类型。
化合物 | 电子式 | 化合物类型 | 化学键类型 |
| _____ | _____ | _____ |
| _____ | _____ | _____ |
B+D | ____ | _____ | _____ |
(3)写出![]() 与
与![]() 所形成的化合物和
所形成的化合物和![]() 与
与![]() 所形成的化合物反应的离子方程式:_______。
所形成的化合物反应的离子方程式:_______。