题目内容
7.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.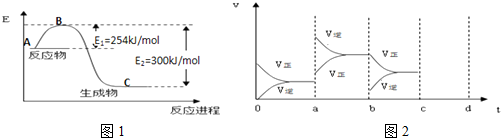
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O (l)△H=-704KJ/mol
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
①如图1是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请计算每生成1mol NH3放出热量为:46KJ
②若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
③若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为18.4kJ
④如图2表示在密闭容器中反应:N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升高温度;若增大压强时,反应速度变化情况画在c~d处.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要战略方向.工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ.mol-1
CH3OH3(g)+H2O(g)═2CH3OH(g)△H2=+23.47kJ.mol-1
则2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H3=-130.8kJ.mol-1
②一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是b(填代号).
a.逆反应速率先增大后减小 b.H2的转化率增大
c.CO2的体积百分含量减小 d.容器中二甲醚的浓度增大
③在一定条件下,将CO2和H2以体积比1:2置于密闭容器中发生上述反应:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)
下列能说明反应达到平衡状态的是abd
a.体系压强不变 b.CO2和H2的体积比不变
c.混合气体的密度不变 d.混合气体的平均相对分子质量不变.
分析 (1)依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量书写热化学方程式,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704KJ,标注物质聚集状态和对应焓变写出;
(2)①先求出此反应的焓变,根据热化学方程式的书写规则再写出热化学方程式;
②根据反应热等于反应物的总键能减去生成物的总键能计算;
③依据化学平衡计算生成氨气物质的量,结合热化学方程式计算放出的热量;
④根据影响化学反应速率和化学平衡的条件可作判断;根据压强对化学反应速率的影响可画出相关的图;
(3)①热化学方程式和盖斯定律计算所得热化学方程式;
②a.逆反应速率先增大后减小,说明平衡向逆反应方向移动;
b.H2的转化率增大,说明平衡向正反应方向移动;
c.CO2的体积百分含量减小,可能为减小二氧化碳的量使平衡向逆反应方向移动;
d.增大二甲醚浓度,平衡逆向进行,容器中二甲醚的浓度增大;
③反应到达平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断;
解答 解:(1)16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704KJ,标注物质聚集状态和对应焓变写出热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O (l)△H=-704KJ/mol;
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O (l)△H=-704KJ/mol;
(2)①反应物总能量大于生成物总能量,应为放热反应,生成1mol氨气放出46kJ热量,则反应的热化学方程式为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g)△H=-46kJ/mol,
故答案为:46KJ;
②反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,
则943KJ/mol+3×435KJ/mol-6x=-92KJ/mol,x=390KJ/mol,
故答案为:390;
③如图是N2和H2反应生成2mol NH3过程中能量变化示意图,反应焓变△H=335KJ/mol-427KJ/mol=-92KJ/mol,
N2(g)+3H2(g)=2NH3(g)△H=-92KJ/mol
1 3 0
0.2 0.6 0.4
生成0.4mol氨气放热=$\frac{0.4mol}{2mol}$×92KJ=18.4KJ;
故答案为:18.4;
④根据图二可知,在a时刻,正逆反应速率都增大,且逆反应速率大于正反应速率,即平衡逆向移动,因为反应的△H<0,根据影响化学反应速率和化学平衡的条件可知,a~b过程中改变的条件可能是升温,在b~c过程后,若增大压强,正逆反应速率都会增大,由于该反应为体积缩小的反应,所以平衡正向移动,根据压强对化学反应速率的影响可画出相关的图为: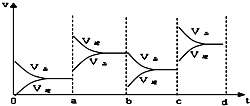 ;
;
故答案为:升高温度; ;
;
(3)①a、CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ.mol-1
b、CH3OH3(g)+H2O(g)═2CH3OH(g)△H2=+23.47kJ.mol-1
依据盖斯定律计算a×2-b得到2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H3=-130.8KJ/mol,
故答案为:-130.8;
②a.逆反应速率先增大后减小,说明平衡向逆反应方向移动,故a不选;
b.H2的转化率增大,说明平衡向正反应方向移动,故b选;
c.CO2的体积百分含量减小,可能为减小二氧化碳的量使平衡向逆反应方向移动,故c不选;
d.增大二甲醚浓度,平衡逆向进行,容器中二甲醚的浓度增大,故d不选;
故选:b;
③2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H3=-130.8KJ/mol,反应是气体体积减小的放热反应,
a.反应前后气体物质的量变化,当体系压强不变说明反应达到平衡状态,故a正确;
b.二氧化碳和氢气反应比为1:3,起始量为1:2,CO2和H2的体积比不变说明反应达到平衡状态,故b正确;
c.反应前后气体质量不变,体积不变,混合气体的密度始终不变,故c错误;
d.反应前后气体质量不变,物质的量变化,当混合气体的平均相对分子质量不变说明反应达到平衡状态,故d正确;
故答案为:abd;
点评 本题综合考查化学反应与能量变化知识,注意物质的总能量、键能与反应热的计算关系,影响反应速率和化学平衡移动的外界因素等知识,题目难度中等,在看图二时要注间线的起点和正逆反应速率的相对大小,进而判断平衡移动方向.

I.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,在一定条件下与H2反应,使之变为可再生燃料甲醇.其流程如图1:
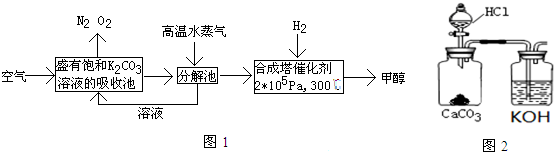
①上述流程中碳酸钾溶液所起的作用是吸收或富集二氧化碳.
②在分解池中发生的反应为2KHCO3$\frac{\underline{\;\;△\;\;}}{\;}$K2CO3+CO2↑+H2O(写出化学方程式).
Ⅱ.碳酸钾是重要的无机化工、医药、轻工原料之一,主要用于医药、玻璃、染料等工业,可用作气体吸附剂,干粉灭火剂,橡胶防老剂等.
已知:CO2、碳酸盐、碳酸氢盐的部分性质如下:CO2(过量)+OH-═HCO3- HCO3-+OH-═CO32-+H2O
CO32-与H+反应生成CO2分两步:CO32-+H+═HCO3-;HCO3-+H+═H2O+CO2↑
①小王同学在实验室用如图2所示的装置和药品制取K2CO3溶液.他所制得的溶液中可能含有的杂质是碳酸氢钾氯化钾或氢氧化钾和氯化钾.
②该同学在数字实验室中用传感器对碳酸钾和碳酸氢钾的混合物样品进行成分测定,他分别称取三份不同质量的混合物样品,配成稀溶液,然后分别逐滴加入相同浓度的50ml硫酸,测得如表数据:
| 实验编号 | 1 | 2 | 3 |
| 混合物的质量/g | 3.76 | 4.70 | 8.46 |
| 硫酸溶液的体积/mL | 50.00 | 50.00 | 50.00 |
| 生成二氧化碳的物质的量/mol | 0.03 | 0.0375 | 0.03 |
| A. | 已知氯化钴及其水合物会呈现不同颜色(如下),德国科学家发明了添加氯化钴的变色水泥,据此推测雨天变色水泥呈粉红色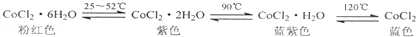 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 | |
| D. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
| A. | $\frac{2b-c}{2a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6a}$ |
| A. | 室温下,稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 溶液中所有离子的浓度都减小 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mLpH=11的NaOH溶液,混合液的pH<7 |
