题目内容
17.室温下,向10mLpH=3的醋酸溶液中加水稀释后,下列说法正确的是( )| A. | 室温下,稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 溶液中所有离子的浓度都减小 | |
| C. | 醋酸的电离程度增大,c(H+)亦增大 | |
| D. | 再加入10mLpH=11的NaOH溶液,混合液的pH<7 |
分析 醋酸是弱电解质,则室温下向10mLpH=3的醋酸溶液中加水稀释将促进电离,离子的数目增多,但溶液的体积增大,则电离产生的离子的浓度减小,并利用温度与电离常数的关系、酸碱混合时pH的计算来解答.
解答 解:A、醋酸是弱电解质,则室温下向10mLpH=3的醋酸溶液中加水稀释将促进电离,离子的数目增多,稀释到原体积的10倍后,溶液的pH<4,故A错误;
B、醋酸加水稀释,溶液酸性减弱,氢氧根离子浓度增大,故B错误;
C、加水稀释时,电离程度增大,但溶液的体积增大的倍数大于n(H+)增加的倍数,则c(H+)减小,故C错误;
D、等体积10mLpH=3的醋酸与pH=11的NaOH溶液混合时,醋酸的浓度大于0.001mol/L,醋酸过量,则溶液的pH<7,故D正确;
故选D.
点评 本题考查弱电解质稀释的有关判断,是高考中的常见题型,属于中等难度的试题.主要是考查学生对弱电解质电离平衡特点以及外界条件对电离平衡影响的熟悉了解程度.答题明确溶液的pH与物质的量浓度的关系、稀释中溶液体积的变化与离子的物质的量的变化程度是解答本题的关键.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
7.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
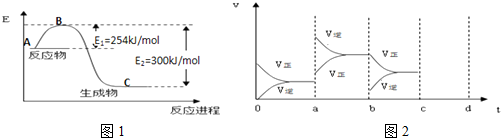
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O (l)△H=-704KJ/mol
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
①如图1是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请计算每生成1mol NH3放出热量为:46KJ
②若已知下列数据:
试根据表中及图中数据计算N-H的键能390kJ•mol-1
③若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为18.4kJ
④如图2表示在密闭容器中反应:N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升高温度;若增大压强时,反应速度变化情况画在c~d处.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要战略方向.工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ.mol-1
CH3OH3(g)+H2O(g)═2CH3OH(g)△H2=+23.47kJ.mol-1
则2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H3=-130.8kJ.mol-1
②一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是b(填代号).
a.逆反应速率先增大后减小 b.H2的转化率增大
c.CO2的体积百分含量减小 d.容器中二甲醚的浓度增大
③在一定条件下,将CO2和H2以体积比1:2置于密闭容器中发生上述反应:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)
下列能说明反应达到平衡状态的是abd
a.体系压强不变 b.CO2和H2的体积比不变
c.混合气体的密度不变 d.混合气体的平均相对分子质量不变.

(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O (l)△H=-704KJ/mol
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
①如图1是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请计算每生成1mol NH3放出热量为:46KJ
②若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
③若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为18.4kJ
④如图2表示在密闭容器中反应:N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升高温度;若增大压强时,反应速度变化情况画在c~d处.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要战略方向.工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ.mol-1
CH3OH3(g)+H2O(g)═2CH3OH(g)△H2=+23.47kJ.mol-1
则2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H3=-130.8kJ.mol-1
②一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是b(填代号).
a.逆反应速率先增大后减小 b.H2的转化率增大
c.CO2的体积百分含量减小 d.容器中二甲醚的浓度增大
③在一定条件下,将CO2和H2以体积比1:2置于密闭容器中发生上述反应:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)
下列能说明反应达到平衡状态的是abd
a.体系压强不变 b.CO2和H2的体积比不变
c.混合气体的密度不变 d.混合气体的平均相对分子质量不变.
8.下列变化过程,属于放热反应的是( )
①水蒸气变成液态水
②酸碱中和反应
③浓硫酸稀释
④固体氢氧化钠溶于水
⑤氢气在氯气中燃烧
⑥食物腐败.
①水蒸气变成液态水
②酸碱中和反应
③浓硫酸稀释
④固体氢氧化钠溶于水
⑤氢气在氯气中燃烧
⑥食物腐败.
| A. | ②③④⑤⑥ | B. | ②③④ | C. | ②⑤⑥ | D. | ①③⑤ |
5.下列说法正确的是( )
| A. | 任何情况下,温度都不可能对反应的方向起决定性作用 | |
| B. | 室温下,CH3COOH的KW=1.7×10-5,NH3•H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3•H2O中的c(OH-)相等 | |
| C. | 用pH试纸测定溶液pH的正确操作是,将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照 | |
| D. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
12.下列关于化学反应速率的说法正确的是( )
| A. | 根据化学反应速率的大小可以知道化学反应进行的快慢 | |
| B. | 化学反应速率是指一定时间内任何一种反应物的量的减少或任何一种生成物的量的增加 | |
| C. | 化学反应速率为0.8mol/(L•s)是指1 s时某物质的浓度为0.8mol/L | |
| D. | 对于任何化学反应来说,反应速率越快,反应现象越明显 |
2.离子方程式中CO32-+2H+═H2O+CO2↑的CO32-不可能来自下列物质中的( )
| A. | K2CO3 | B. | Na2CO3 | C. | CaCO3 | D. | (NH4)2CO3 |
9.水的三态的熵值的大小关系正确的是( )
| A. | S (s)>S (l)>S (g) | B. | S (g)>S (l)>S (s) | C. | S (l)>S (s)>S (g) | D. | S (g)>S (s)>S (l) |
6.在四个不同的容器中,在不同的条件下进行合成氨反应N2+3H2?2NH3,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
| A. | v(NH3)=0.3 mol/(L•min) | B. | v(N2)=0.01 mol/(L•s) | ||
| C. | v(N2)=0.2 mol/(L•min) | D. | v(H2)=0.3 mol/(L•min) |
7.焙制糕点时,常用到小苏打粉,小苏打的化学式为( )
| A. | NaNO3 | B. | Na2CO3 | C. | NaHCO3 | D. | Na2SO4 |