题目内容
16.在a L Al2(SO4)3和(NH4)2SO4的混合溶液中加入b mol BaCl2,恰好使溶液中的SO42-离子完全沉淀;如加入足量强碱并加热可得到c mol NH3,(已知NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O)则原溶液中的Al3+的物质的量浓度(mol•L-1)为( )| A. | $\frac{2b-c}{2a}$ | B. | $\frac{2b-c}{a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6a}$ |
分析 根据反应SO42-+Ba2+═BaSO4↓计算溶液中的SO42-离子的物质的量,根据离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O计算NH4+的物质的量,再根据c=$\frac{n}{V}$计算出溶液中硫酸根离子、铵根离子的浓度,最后利用电荷守恒来计算原溶液中的Al3+浓度.
解答 解:由混合溶液中加入bmolBaCl2,恰好使溶液中的SO42-离子完全沉淀,
则SO42-+Ba2+═BaSO4↓
bmol bmol
c(SO42-)=$\frac{bmol}{aL}$=$\frac{b}{a}$mol/L,
由加入足量强碱并加热可得到cmol NH3,
则NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O
cmol cmol
c(NH4+)=$\frac{cmol}{aL}$=$\frac{c}{a}$mol/L,
由于溶液不显电性,设原溶液中的Al3+浓度为x,由电荷守恒可知,
x×3+$\frac{c}{a}$mol/L×1=$\frac{b}{a}$mol/L×2,
解得:x=$\frac{2b-c}{3a}$mol/L,
故选C.
点评 本题考查物质的量浓度的计算,题目难度中等,明确发生的离子反应及溶液不显电性是解答本题的关键,并熟悉浓度的计算公式来解答即可.

练习册系列答案
相关题目
7.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O (l)△H=-704KJ/mol
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
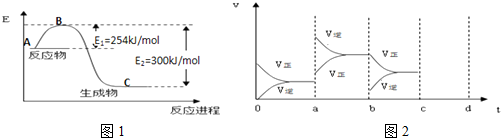
①如图1是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请计算每生成1mol NH3放出热量为:46KJ
②若已知下列数据:
试根据表中及图中数据计算N-H的键能390kJ•mol-1
③若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为18.4kJ
④如图2表示在密闭容器中反应:N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升高温度;若增大压强时,反应速度变化情况画在c~d处.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要战略方向.工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ.mol-1
CH3OH3(g)+H2O(g)═2CH3OH(g)△H2=+23.47kJ.mol-1
则2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H3=-130.8kJ.mol-1
②一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是b(填代号).
a.逆反应速率先增大后减小 b.H2的转化率增大
c.CO2的体积百分含量减小 d.容器中二甲醚的浓度增大
③在一定条件下,将CO2和H2以体积比1:2置于密闭容器中发生上述反应:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)
下列能说明反应达到平衡状态的是abd
a.体系压强不变 b.CO2和H2的体积比不变
c.混合气体的密度不变 d.混合气体的平均相对分子质量不变.

(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O (l)△H=-704KJ/mol
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
①如图1是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请计算每生成1mol NH3放出热量为:46KJ
②若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
③若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为18.4kJ
④如图2表示在密闭容器中反应:N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升高温度;若增大压强时,反应速度变化情况画在c~d处.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要战略方向.工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ.mol-1
CH3OH3(g)+H2O(g)═2CH3OH(g)△H2=+23.47kJ.mol-1
则2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H3=-130.8kJ.mol-1
②一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是b(填代号).
a.逆反应速率先增大后减小 b.H2的转化率增大
c.CO2的体积百分含量减小 d.容器中二甲醚的浓度增大
③在一定条件下,将CO2和H2以体积比1:2置于密闭容器中发生上述反应:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)
下列能说明反应达到平衡状态的是abd
a.体系压强不变 b.CO2和H2的体积比不变
c.混合气体的密度不变 d.混合气体的平均相对分子质量不变.
1.BF3与一定量的水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R.反应过程中新形成的化学键中无( )


| A. | 离子键 | B. | 配位键 | C. | 金属键 | D. | 氢键 |
8.下列变化过程,属于放热反应的是( )
①水蒸气变成液态水
②酸碱中和反应
③浓硫酸稀释
④固体氢氧化钠溶于水
⑤氢气在氯气中燃烧
⑥食物腐败.
①水蒸气变成液态水
②酸碱中和反应
③浓硫酸稀释
④固体氢氧化钠溶于水
⑤氢气在氯气中燃烧
⑥食物腐败.
| A. | ②③④⑤⑥ | B. | ②③④ | C. | ②⑤⑥ | D. | ①③⑤ |
5.下列说法正确的是( )
| A. | 任何情况下,温度都不可能对反应的方向起决定性作用 | |
| B. | 室温下,CH3COOH的KW=1.7×10-5,NH3•H2O的Kb=1.7×10-5,CH3COOH溶液中的c(H+)与NH3•H2O中的c(OH-)相等 | |
| C. | 用pH试纸测定溶液pH的正确操作是,将一小条试纸在待测液中蘸一下,取出后放在表面皿上,与标准比色卡对照 | |
| D. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
6.在四个不同的容器中,在不同的条件下进行合成氨反应N2+3H2?2NH3,根据下列在相同时间内测得的结果判断,生成氨的反应速率最快的是( )
| A. | v(NH3)=0.3 mol/(L•min) | B. | v(N2)=0.01 mol/(L•s) | ||
| C. | v(N2)=0.2 mol/(L•min) | D. | v(H2)=0.3 mol/(L•min) |
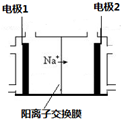 电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,其中如图是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息(通电以后Na+的移动方向)判断电极2的名称是阴极,并写出电极1的电极反应式2Cl--2e-=Cl2↑.
电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”.在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,其中如图是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息(通电以后Na+的移动方向)判断电极2的名称是阴极,并写出电极1的电极反应式2Cl--2e-=Cl2↑. 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为实验室制取蒸馏水的装置.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为实验室制取蒸馏水的装置.