题目内容
12.CO可用于炼铁,已知Fe2O3(s)+3C(s)═2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1,C(s)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1,则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1.分析 依据热化学方程式和盖斯定律计算得到所需热化学方程式,①-②×3得到所需热化学方程式;
解答 解:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依据盖斯定律①-②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
点评 本题主要考查了热化学方程式的书写,盖斯定律和计算应用是解题关键,题目较简单.

练习册系列答案
 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
3.下列说法正确的是( )
| A. | 在化学反应中,原子重新组合时伴随着能量的变化 | |
| B. | 淀粉和纤维素的化学式均为(C6H10O5)n,故互为同分异构体 | |
| C. | 通过化学变化可以“点石成金”,即可将黏土转化成金单质 | |
| D. | 等质量的铝粉按a、b两种途径完全转化,途径a比途径b消耗更多的NaOH 途径a:Al$→_{点燃}^{O_{2}}$Al2O3$\stackrel{NaOH溶液}{→}$NaAlO2;途径b:Al$\stackrel{NaOH溶液}{→}$NaAlO2 |
1.将标况下的2.24LCO2通入150mL 1mol•L-1NaOH溶液中,溶液中离子浓度由小到大的顺序为 ( )
| A. | c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | B. | c(Na+)>c(HCO3-)=c(CO32-)>c(OH-)>c(H+). | ||
| C. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | D. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
7.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
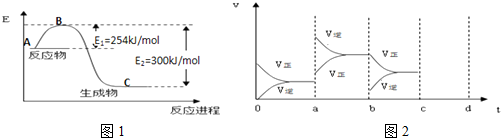
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O (l)△H=-704KJ/mol
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
①如图1是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请计算每生成1mol NH3放出热量为:46KJ
②若已知下列数据:
试根据表中及图中数据计算N-H的键能390kJ•mol-1
③若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为18.4kJ
④如图2表示在密闭容器中反应:N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升高温度;若增大压强时,反应速度变化情况画在c~d处.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要战略方向.工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ.mol-1
CH3OH3(g)+H2O(g)═2CH3OH(g)△H2=+23.47kJ.mol-1
则2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H3=-130.8kJ.mol-1
②一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是b(填代号).
a.逆反应速率先增大后减小 b.H2的转化率增大
c.CO2的体积百分含量减小 d.容器中二甲醚的浓度增大
③在一定条件下,将CO2和H2以体积比1:2置于密闭容器中发生上述反应:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)
下列能说明反应达到平衡状态的是abd
a.体系压强不变 b.CO2和H2的体积比不变
c.混合气体的密度不变 d.混合气体的平均相对分子质量不变.

(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O (l)△H=-704KJ/mol
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
①如图1是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请计算每生成1mol NH3放出热量为:46KJ
②若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ•mol-1 | 435 | 943 |
③若起始时向容器内放入1mol N2和3mol H2,达平衡后N2的转化率为20%,则反应放出的热量为18.4kJ
④如图2表示在密闭容器中反应:N2(g)+3H2(g)?2NH3(g)△H<0,达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a~b过程中改变的条件可能是升高温度;若增大压强时,反应速度变化情况画在c~d处.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要战略方向.工业上用CO2和H2反应合成二甲醚.已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJ.mol-1
CH3OH3(g)+H2O(g)═2CH3OH(g)△H2=+23.47kJ.mol-1
则2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H3=-130.8kJ.mol-1
②一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是b(填代号).
a.逆反应速率先增大后减小 b.H2的转化率增大
c.CO2的体积百分含量减小 d.容器中二甲醚的浓度增大
③在一定条件下,将CO2和H2以体积比1:2置于密闭容器中发生上述反应:2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)
下列能说明反应达到平衡状态的是abd
a.体系压强不变 b.CO2和H2的体积比不变
c.混合气体的密度不变 d.混合气体的平均相对分子质量不变.
1.BF3与一定量的水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R.反应过程中新形成的化学键中无( )


| A. | 离子键 | B. | 配位键 | C. | 金属键 | D. | 氢键 |
2.离子方程式中CO32-+2H+═H2O+CO2↑的CO32-不可能来自下列物质中的( )
| A. | K2CO3 | B. | Na2CO3 | C. | CaCO3 | D. | (NH4)2CO3 |
 处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为:
处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S(g).发生反应为: 掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为实验室制取蒸馏水的装置.
掌握仪器的名称、组装及使用方法是中学化学实验的基础,如图为实验室制取蒸馏水的装置.