题目内容
(15分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
| A.连接好仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
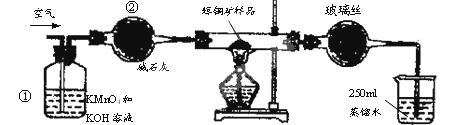
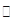 SO2 +2Cu。
SO2 +2Cu。F.移取25.00mL含SO2的水溶液于250mL锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系:c2 (H+)·(S2-) =" 1" . 0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为1 mol/L,应调节溶液的c(H十)为__________________。
(1)除去空气中的还原性气体与酸性气体 (2分)
干燥空气 (2分)
(2)2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O (2分)
滴入最后一滴标准KMnO4溶液后,溶液由无色变为淡紫色,并在半分钟内不褪色 (2分)
(3)80% (2分)
(4)在KMnO4滴定前,未反应完的O2与空气中的O2也可将H2SO3氧化,造成测定结果偏低 (2分)
(5)4 ×10-3mol/L (2分)
解析试题分析:
(1)装置①的作用是:除去空气中的还原性气体与酸性气体;装置②的作用是:干燥空气。
(2)2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O 滴入最后一滴标准KMnO4溶液后,溶液由无色变为淡紫色,并在半分钟内不褪色
(3)高锰酸钾三次的次的用量分别为:19.99 mL、20.01 mL、18.04 mL,第三组数据有明显的误差,可以舍去不用,前两次的的平均值为:20.00mL
2KMnO4---------------------5H2SO3--------------------5 SO2------------- 5Cu2S
2 5
0.0100mol/L×20.00mL X
解之得:X=5×10-4 mol
那么辉铜矿样品中Cu2S的质量分数是:w(Cu2S)=
(4)在KMnO4滴定前,未反应完的O2与空气中的O2也可将H2SO3氧化,造成测定结果偏低
(5)Ksp(FeS)=c(Fe2+)·c(S2-)= 6 . 25 × 10 -18
当溶液中(Fe2+)为1 mol/L时,c(S2-)=6 . 25 × 10 -18 mol/L,
应调节溶液的c(H十)为:c2(H+)=
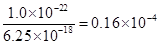
c (H+)= 4 ×10-3mol/L  考点:考查化学实验,滴定、以及溶解平衡。
考点:考查化学实验,滴定、以及溶解平衡。

下列叙述正确的是
| A.相同温度下,中和pH=1的盐酸和醋酸各20.0mL,需要0.100 mol·L-1NaOH都是20.0mL |
| B.0.1mol·L-1Na2CO3中加入少量NaOH固体后振荡,c(Na+)和c(CO32-)都增大 |
| C.常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Ksp(AgCl)增大 |
| D.相同浓度的CH3COOH和 CH3COONa溶液等体积混合后,则:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
常温下,下列各组比值为1∶2的是
| A.0.1 mol/L与0.2 mol/L醋酸溶液,c(H+)之比 |
| B.0.1 mol/L Na2CO3溶液,c(CO32-)与c(Na+)之比 |
| C.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比 |
| D.pH=3的硫酸与醋酸溶液,c(SO42-)与c(CH3COO-)之比 |
(5分)常温下,将三种一元酸(HX、HY、HZ)分别和NaOH溶液等体积混合,实验数据如下:
| 酸 | c(一元酸) /mol·L–1 | c(NaOH) /mol·L–1 | 混合溶液的pH |
| HX | 0.1 | 0.1 | pH = x |
| HY | 0.1 | 0.1 | pH = 7 |
| HZ | 0.1 | 0.1 | pH = 9 |
(2)HZ和NaOH发生反应的离子方程式为 ,所得溶液中pH大于7的原因是 (用化学方 程式表示)。
(3)HX反应后所得溶液中,由水电离产生的c(OH-)= mol·L-1,下列叙述是对x 值的判断,其 中正确的是 。
A.一定=7 B.可能<7 C. 一定≧7 D.一定>7
(8分)取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是 (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+) 0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填“>”、“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3; | B.NH4A; | C.(NH4)2SO4; | D.NH4Cl,按pH由大到小的顺序排列(填序号)。 |
5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
| 阳离子 | Na+ Al3+ Fe3+ Cu2+、 Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol·L-1稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A、C的化学式为:A ;C 。
(2)写出步骤②中发生反应的化学方程式 。
(3)D溶液中滴入石蕊试液,现象是 ,
原因是 (用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是 mL。
(5)现用500 mL 3 mol·L-1的E溶液充分吸收11.2 L CO2气体(标准状况 下),反应后溶液中各离子的物质量浓度由小到大的顺序为 。
(6)若用惰性电极电解A和B的混合溶液,溶质的物质的量均为0.1 mol,请在坐标系中画出通电后阳极产生气体的体积(标准状况下)V与通过电子的物质的量n的关系(不考虑气体溶于水)。
 ’
’  (2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
(2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
 w.w.w.zxxk.c.o.m
w.w.w.zxxk.c.o.m