题目内容
(5分)常温下,将三种一元酸(HX、HY、HZ)分别和NaOH溶液等体积混合,实验数据如下:
| 酸 | c(一元酸) /mol·L–1 | c(NaOH) /mol·L–1 | 混合溶液的pH |
| HX | 0.1 | 0.1 | pH = x |
| HY | 0.1 | 0.1 | pH = 7 |
| HZ | 0.1 | 0.1 | pH = 9 |
(2)HZ和NaOH发生反应的离子方程式为 ,所得溶液中pH大于7的原因是 (用化学方 程式表示)。
(3)HX反应后所得溶液中,由水电离产生的c(OH-)= mol·L-1,下列叙述是对x 值的判断,其 中正确的是 。
A.一定=7 B.可能<7 C. 一定≧7 D.一定>7
(5分)(1)HY
(2)HZ +OH- ="=" H2O + Z-, H2O + Z- HZ+OH-
HZ+OH-
(3)10x-14 C
解析试题分析:(1)等物质的量的酸与氢氧化钠混合,溶液的酸碱性取决于酸的强弱,若酸是强酸,则溶液呈中性,若酸是弱酸,则溶液呈碱性,所以上述三种酸中一定属于强酸的是HY;
(2)从HZ与氢氧化钠混合液的pH判断HZ是弱酸,酸性离子方程式时不能拆成离子形式,所以离子方程式为HZ +OH- ="=" H2O + Z-,所得溶液中pH大于7的原因是因为Z-水解使溶液呈碱性,水解的离子方程式为H2O + Z- HZ+OH-
HZ+OH-
(3)HX与氢氧化钠溶液反应后的溶液的pH=x,则溶液中的c(H+)=10-xmol/L,溶液中的c(OH-)=10x-14 mol/L,HX若为强酸该溶液为中性溶液,若为弱酸,则该溶液为碱性溶液,所以溶液中的OH-的浓度即是水电离产生的OH-的浓度,c(OH-)=10x-14 mol/L;根据以上分析,x≧7,答案选C。
考点:考查酸、碱反应混合液的pH的判断,离子浓度的计算,水解离子方程式的书写

练习册系列答案
相关题目
下列叙述正确的是
| A.电解精炼铜时,转移1mol电子,阳极上溶解的铜原子数必为0.5NA |
| B.常温下,4.4gCO2和N2O混合物中所含有的原子数为0.3×6.02×1023 |
| C.等体积0.2mol·L-1HCl溶液与0.05mol·L-1Ba(OH)2溶液混合后,溶液的pH=1 |
| D.溶液中由水电离出的c(H+)=1×10-12mol/L,SO42-、NO3-、Fe2+、Mg2+能大量共存 |
(9分)下表是不同温度下水的离子积常数:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | KW | 1×10-12 |
(1)若25℃<t1<t2,则KW__________1×10-14(填“>”、“<”或“=”),判断的理由是 。
(2)25℃ 下,将pH=13的氢氧化钠溶液V1 L与pH=1的稀盐酸V2 L混合(设混合后溶液的体积为:V1+V2),所得混合溶液的pH=2,则V1 : V2=__________。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”、“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“>”、“=”或“<”)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性(填“酸”、 “中”或“碱”),溶液中c(Na+) c(CH3COO-)[填“>”、“=”或“<”] 。
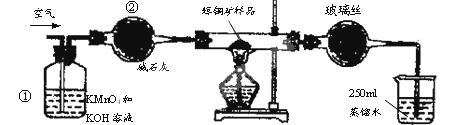
(15分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
| A.连接好仪器,使其成为如图装置,并检查装置的气密性。 |
| B.称取研细的辉铜矿样品1.000g。 |
| C.将称量好的样品小心地放入硬质玻璃管中。 |
| D.以每分钟1L的速率鼓入空气。 |
 SO2 +2Cu。
SO2 +2Cu。F.移取25.00mL含SO2的水溶液于250mL锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为 ,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
(5)已知在常温下FeS 的 Ksp= 6 . 25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系:c2 (H+)·(S2-) =" 1" . 0×10-22。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为1 mol/L,应调节溶液的c(H十)为__________________。
活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):
已知:几种离子生成氢氧化物沉淀时的pH如表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
请回答下列问题:
(1)步骤A加H2O2发生反应的离子方程式是 ,该步骤需控制溶液pH的范围是 。
(2)A溶液中主要含有的溶质是 。
(3)碱式碳酸锌经焙烧制得活性ZnO的反应ΔH>0,该反应能自发进行的原因是ΔS (选填“=”、“>”或“<”)0。
(4)若经处理后的废水pH=8,此时Zn2+的浓度为 mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17)。

 N2(g)+2CO2(g)的△H是______。
N2(g)+2CO2(g)的△H是______。