题目内容
5. 在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A. | 盐酸中逐滴加入食盐溶液 | B. | 硫酸中逐滴加入氢氧化钠溶液 | ||
| C. | 硫酸中逐滴加入氢氧化钡溶液 | D. | 醋酸中逐滴加入氨水 |
分析 若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,说明溶液中电解质的浓度降低,说明所加入物质能与溶液中电解质反应生成弱电解质或沉淀,至熄灭后又逐渐变亮,说明完全反应时溶液电荷浓度接近0,当另一溶液过量时,溶液中电荷浓度逐渐增大,又逐渐变亮.
解答 解:A.HCl是强电解质,在水溶液里完全电离,加入NaCl后,二者不反应,溶液中电荷浓度不是0,所以不熄灭,故A错误;
B.硫酸和NaOH都是强电解质,二者发生反应H2SO4+2NaOH=Na2SO4+H2O,生成的硫酸钠是强电解质,溶液中离子浓度减小,所以灯泡变暗,但不熄灭,故B错误;
C.硫酸和氢氧化钡都是强电解质,二者发生反应Ba(OH)2+H2SO4=BaSO4↓+2H2O,反应后生成难溶物和弱电解质,溶液中离子浓度逐渐减小,所以灯泡变暗,二者恰好反应时离子浓度最小,灯泡熄灭,再继续滴加氢氧化钡,溶液中离子浓度增大,灯泡变亮,符合题意,故C正确;
D.醋酸、一水合氨都为弱电解质,二者反应生成醋酸铵,溶液导电性增强,不存在熄灭的现象,故D错误.
故选C.
点评 本题考查电解质的电离及离子反应,明确溶液导电性与离子浓度关系是解本题关键,溶液导电性与离子浓度、电荷有关,与电解质强弱无关,为易错点.

练习册系列答案
相关题目
15.下列说法正确的是( )
| A. | 干冰升华和液氯气化时要破坏不同的微粒间作用力 | |
| B. | CO2和SiO2具有相同的化学键类型和晶体类型 | |
| C. | 水结成冰体积膨胀、密度变小,这一事实与水分子间存在氢键有关 | |
| D. | 盐酸能电离出氢离子和氯离子,所以HCl中存在离子键 |
16. 在密闭容器中通入CH4与CO2,使其物质的量浓度均为0.1mol•L-1,在一定条件下发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),测得平衡时CH4的转化率与温度及压强的关系如图所示,下列有关说法一定正确的是( )
在密闭容器中通入CH4与CO2,使其物质的量浓度均为0.1mol•L-1,在一定条件下发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),测得平衡时CH4的转化率与温度及压强的关系如图所示,下列有关说法一定正确的是( )
 在密闭容器中通入CH4与CO2,使其物质的量浓度均为0.1mol•L-1,在一定条件下发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),测得平衡时CH4的转化率与温度及压强的关系如图所示,下列有关说法一定正确的是( )
在密闭容器中通入CH4与CO2,使其物质的量浓度均为0.1mol•L-1,在一定条件下发生反应:CO2(g)+CH4(g)?2CO(g)+2H2(g),测得平衡时CH4的转化率与温度及压强的关系如图所示,下列有关说法一定正确的是( )| A. | 上述反应的△H<0 | B. | 压强P1<P2<P3<P4 | ||
| C. | 1100℃该反应的平衡常数为64 | D. | 压强为P4时,在Y点:v(正)<v(逆) |
13.反应2C(s)+O2(g)=2CO(g) 的能量变化如图所示,下列说法正确的是( )

| A. | 生成物的总能量大于反应物的总能量 | |
| B. | △H<0,表明该反应在常温下一定能发生 | |
| C. | 2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ | |
| D. | 该反应的热化学方程式是:2C(s)+O2(g)=2CO(g)△H=-110.5 kJ/mol |
20.结构简式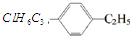 表示的有机物中,能发生消去反应的卤代烃共有( )
表示的有机物中,能发生消去反应的卤代烃共有( )
 表示的有机物中,能发生消去反应的卤代烃共有( )
表示的有机物中,能发生消去反应的卤代烃共有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
10.下列有机物中,属于烷烃的是( )
| A. | C2H6 | B. | C2H2 | C. | C6H6 | D. | C2H4O |
14.已知反应3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,当转移6mol电子时,被还原的HNO3的物质的量为( )
| A. | 8mol | B. | 4mol | C. | 2mol | D. | 6mol |
19.对于淀粉和纤维素的叙述,正确的是( )
| A. | 因为都是多糖,所以都有甜味 | |
| B. | 因为具有相同的分子式(C6H10H5)n,所以互为同分异构体 | |
| C. | 两者都能水解为葡萄糖 | |
| D. | 两者都是人类的营养食物 |
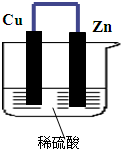 如图所示,将锌、铜通过导线相连,置于稀硫酸中.
如图所示,将锌、铜通过导线相连,置于稀硫酸中.