题目内容
15.pH值相等的盐酸(甲)和醋酸(乙),分别与锌反应,若最后锌已全部溶解且放出气体一样多,为此下列说法正确的是( )| A. | 反应开始时的速率:甲>乙 | |
| B. | 反应结束时,pH值:甲=乙 | |
| C. | 反应开始时,酸的物质的量浓度:甲=乙 | |
| D. | 反应所需时间:甲>乙 |
分析 pH相同的盐酸(甲)和醋酸(乙),则两种溶液中氢离子浓度相等,反应速率和离子浓度成正比,醋酸是弱电解质,氯化氢是强电解质,所以c(HCl)<c(CH3COOH),若最后锌粒全部溶解且放出气体一样多,可能是盐酸恰好反应而醋酸过量,也可能是盐酸和醋酸都过量,据此分析解答.
解答 解:A.pH相同的盐酸(甲)和醋酸(乙),两种溶液中氢离子浓度相等,所以开始反应速率相等,故A错误;
B.完全反应后,醋酸一定有剩余,醋酸中氢离子浓度大于盐酸,所以反应结束时,pH值:甲>乙,故B错误;
C.pH相同的盐酸(甲)和醋酸(乙),醋酸是弱电解质,氯化氢是强电解质,所以c(HCl)<c(CH3COOH),故C错误;
D.反应过程中,醋酸电离导致醋酸中氢离子浓度减少速率小于盐酸中氢离子浓度减少速率,盐酸中的氢离子浓度小于醋酸中氢离子浓度,盐酸反应速率小于醋酸,所以反应所需时间为甲>乙,故D正确;
故选D.
点评 本题考查了弱电解质的电离,根据影响反应速率的因素、弱电解质电离特点、物质的性质等知识点来分析解答,反应速率与离子浓度有关,与电解质强弱无关,为易错点.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
7.硅元素有质量数为28、29、30三种同位素,硅元素的近似相对原子质量为28.1,自然界中质量数为28的硅原子百分含量为92%,则质量分数为29、30的原子个数比为( )
| A. | 3:5 | B. | 3:1 | C. | 2:3 | D. | 3:2 |
3.将溶液中的Mg2+、Al3+分离,可选用的试剂是( )
| A. | 氨水 | B. | NaOH | C. | NaOH和盐酸 | D. | K2CO3溶液 |
10.下列各项括号里的物质或操作是除去杂质所用的药品或方法,其中错误的是( )
| A. | CaO中混有CaCO3(高温煅烧) | B. | CO混有CO2(石灰水) | ||
| C. | H2中混有HCl(NaOH溶液) | D. | Ca(OH)2中混有CaCO3(盐酸) |
20.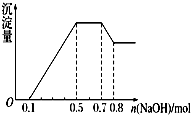 某溶液中可能含有H+、NH${\;}_{4}^{+}$、Mg2+、Al3+、Fe3+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )
某溶液中可能含有H+、NH${\;}_{4}^{+}$、Mg2+、Al3+、Fe3+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )
 某溶液中可能含有H+、NH${\;}_{4}^{+}$、Mg2+、Al3+、Fe3+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )
某溶液中可能含有H+、NH${\;}_{4}^{+}$、Mg2+、Al3+、Fe3+、CO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法不正确的是( )| A. | 溶液中的阳离子有H+、Mg2+、Al3+、NH${\;}_{4}^{+}$ | |
| B. | 溶液中n(NH${\;}_{4}^{+}$)=0.2 mol | |
| C. | 溶液中一定不含CO${\;}_{3}^{2-}$和NO${\;}_{3}^{-}$,可能含有SO${\;}_{4}^{2-}$ | |
| D. | n(H+):n(Al3+):n(Mg2+)=2:2:1 |
7.下列各组物质相互反应,能产生可燃性气体的是( )
| A. | 电石投入食盐水 | B. | 铜投入浓硝酸 | ||
| C. | 炭投入热的浓硫酸 | D. | 碳酸钙投入盐酸 |
2.某溶液中含有Na+、Mg2+和SO42-三种离子,其中Na+和Mg2+的物质的量分别为0.2mol、0.3mol,则溶液中SO42-的物质的量为( )
| A. | 0.4mol | B. | 0.5mol | C. | 0.8mol | D. | 1.6mol |
3.检验集气瓶里的氧气是否收集满,应将带火星的木条( )
| A. | 插入集气瓶中 | B. | 插入集气瓶底 | C. | 放在集气瓶口 | D. | 都可以 |
 如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是C(填序号).
如图所示装置是化学实验室中的常用装置,它有多种用途,以下各项用途和操作都正确的是C(填序号).