题目内容
某可逆反应:a A(g)+b B(g) c C(g)+d D(g) △H = -Q kJ/mol(Q为正值),达平衡状态后,下列结论中不正确的是
c C(g)+d D(g) △H = -Q kJ/mol(Q为正值),达平衡状态后,下列结论中不正确的是
A.若a+b=c+d,则往含有w mol气体的平衡体系中再加入w mol的B,达到新平衡时,气体的总物质的量等于2w mol
B.若平衡时,A、B 的转化率相等,说明反应开始时加入的A、B的物质的量之比为 a︰b
C.在相同条件下,两相同容器中分别加入amolA、bmolB和cmolC、dmolD,达到平衡状态后,前者放出热量Q1 kJ,后者吸收热量Q2 kJ,则Q1+ Q2 = Q
D.若温度不变,将容器的体积缩小到原来的一半,A的浓度为原来的1.9倍,则a+b<c+d
 c C(g)+d D(g) △H = -Q kJ/mol(Q为正值),达平衡状态后,下列结论中不正确的是
c C(g)+d D(g) △H = -Q kJ/mol(Q为正值),达平衡状态后,下列结论中不正确的是A.若a+b=c+d,则往含有w mol气体的平衡体系中再加入w mol的B,达到新平衡时,气体的总物质的量等于2w mol
B.若平衡时,A、B 的转化率相等,说明反应开始时加入的A、B的物质的量之比为 a︰b
C.在相同条件下,两相同容器中分别加入amolA、bmolB和cmolC、dmolD,达到平衡状态后,前者放出热量Q1 kJ,后者吸收热量Q2 kJ,则Q1+ Q2 = Q
D.若温度不变,将容器的体积缩小到原来的一半,A的浓度为原来的1.9倍,则a+b<c+d
D
A正确,由于该反应为等体积反应,反应前后气体的总物质的量不变。
B正确,因为转化率等于变化的量除以起始量,而变化的量双等于化学计量数之比,所以,若转化率相同,则反应开始时加的物质的量之比必为化学计量数之比;
C正确,由于该两种投料方式达到平衡时为等效平衡,所以,它们达到平衡时热量的关系为Q1+ Q2 = Q。
D错,若温度不变,将容器的体积缩小到原来的一半,在这个瞬间,A的浓度突变为原来的2倍,而平衡后A的的浓度为原来的1.9倍,即缩小体积,平衡向正反应方向移动了,即正反应的方向为气体体积减小的方向。所以其关系为:c+d<a+b。
B正确,因为转化率等于变化的量除以起始量,而变化的量双等于化学计量数之比,所以,若转化率相同,则反应开始时加的物质的量之比必为化学计量数之比;
C正确,由于该两种投料方式达到平衡时为等效平衡,所以,它们达到平衡时热量的关系为Q1+ Q2 = Q。
D错,若温度不变,将容器的体积缩小到原来的一半,在这个瞬间,A的浓度突变为原来的2倍,而平衡后A的的浓度为原来的1.9倍,即缩小体积,平衡向正反应方向移动了,即正反应的方向为气体体积减小的方向。所以其关系为:c+d<a+b。

练习册系列答案
相关题目
 Fe(SCN)3+3NH4Cl溶液显红色,加少量NH4Cl固体后颜色变浅
Fe(SCN)3+3NH4Cl溶液显红色,加少量NH4Cl固体后颜色变浅 和8mol
和8mol 在一定条件下反应,达到平衡时,
在一定条件下反应,达到平衡时,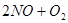

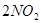 达到平衡的标志是
达到平衡的标志是 H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表: 4
4
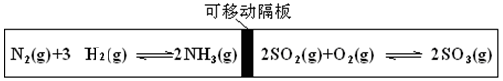
 自由移动。T℃时,M、
自由移动。T℃时,M、 N两个容器中均发生反应N2(g)+3H2(g)
N两个容器中均发生反应N2(g)+3H2(g) 2NH3(g),向容器M、N中各充入l mol N2和3 mol H2,初始M、N的容积和温度相同,并保持温度不变。下列有关说法中不正确的是 ( )
2NH3(g),向容器M、N中各充入l mol N2和3 mol H2,初始M、N的容积和温度相同,并保持温度不变。下列有关说法中不正确的是 ( )

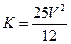
 2NO2(气),不能说明已达到平衡状态的是
2NO2(气),不能说明已达到平衡状态的是