题目内容
(8分)已知反应:CO(g) + H2O(g) H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
请回答下列问题:
(1)上述可逆反应中Q 0(填“大于”或“小于”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图。试回答:

①0~4 min的平均反应速率v(CO)="______" mol/(L·min)
②下列表述能作为该可逆反应达到平衡标志的是__________(填序号)。
A.当混合气体的密度保持不变时
B.当反应消耗0.1molCO(g) 同时也生成0.1molH2O(g)时
C.当CO(g)的质量分数保持不变时
D.当该反应的ΔH不变时
(3)若要加快该反应速率,同时还要提高CO的转化率,可采取的措施为_____(填序号)。
A.增加水蒸气的量 B.降低温度
C.使用催化剂 D.增大压强 E.不断移走CO2
 H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.9 4 4 | 9 | 1 |
(1)上述可逆反应中Q 0(填“大于”或“小于”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图。试回答:

①0~4 min的平均反应速率v(CO)="______" mol/(L·min)
②下列表述能作为该可逆反应达到平衡标志的是__________(填序号)。
A.当混合气体的密度保持不变时
B.当反应消耗0.1molCO(g) 同时也生成0.1molH2O(g)时
C.当CO(g)的质量分数保持不变时
D.当该反应的ΔH不变时
(3)若要加快该反应速率,同时还要提高CO的转化率,可采取的措施为_____(填序号)。
A.增加水蒸气的量 B.降低温度
C.使用催化剂 D.增大压强 E.不断移走CO2
(8分)
(1)小于(2分)
(2)①0.03(2分) ②BC(2分,答对1个得1分,见错得0分。)
(3)A(2分)
(1)小于(2分)
(2)①0.03(2分) ②BC(2分,答对1个得1分,见错得0分。)
(3)A(2分)
略

练习册系列答案
相关题目
 2NH3,下列说法正确的是
2NH3,下列说法正确的是 5 kJ/mol
5 kJ/mol  。(填序号)
。(填序号) c C(g)+d D(g) △H = -Q kJ/mol(Q为正值),达平衡状态后,下列结论中不正确的是
c C(g)+d D(g) △H = -Q kJ/mol(Q为正值),达平衡状态后,下列结论中不正确的是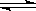 xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2。
xC(g)达到平衡,此时测得甲、乙两容器中C的体积分数都为0.2。 2NH3(g);△H=" " -92.2KJ·mol-1,已知:平衡时容器内气体的压强为开始的80%.
2NH3(g);△H=" " -92.2KJ·mol-1,已知:平衡时容器内气体的压强为开始的80%. 到平衡状态时,放出的热量为
到平衡状态时,放出的热量为  __
__ Z(g)+2W(g)。达平衡时,A的体积为1.2aL。下列说法正确的是
Z(g)+2W(g)。达平衡时,A的体积为1.2aL。下列说法正确的是