题目内容
【题目】钠及其化合物有非常重要的用途。
(1)钠的化学性质非常活泼。画出钠的原子结构示意图________。
钠与水反应的实验过程如图①、②、③所示。
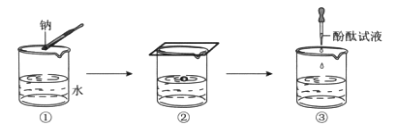
①将图②中的现象与解释用直线连接起来。_________
实验现象 解释
钠熔成小球 产生了气体
钠四处游动,嘶嘶作响 钠的密度比水小
钠浮在水面上 钠与水反应放热且钠的熔点低
②在③中酚酞变红,说明溶液呈_______(填“酸”或“碱”或“中”)性。
③钠与水反应的化学方程式是_________。
(2)过氧化钠可在潜水艇中作为氧气的来源。写出过氧化钠与水反应的化学方程式___,与二氧化碳反应的化学方程式___。
(3)为探究Na2CO3和NaHCO3的热稳定性,某同学设计了如下实验:
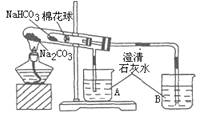
加热一段时间后,________(填“A”或“B”)中澄清石灰水变浑浊,写出澄清石灰水变浑浊的离子方程式:________。写出试管中发生反应的化学方程式________。
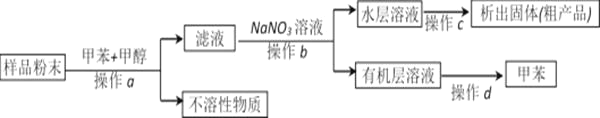
(4)我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如图所示(部分物质已略去)。含有氮元素、钾元素、磷元素的某些盐可以作为化肥。
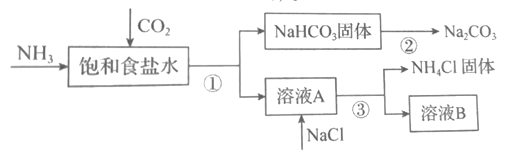
①联合制碱法所制得的“碱”是指_______(填化学式)。
②在①-③所涉及的操作方法中,包含过滤的是_______(填序号)。
③根据图,将化学方程式补充完整:NH3+CO2+___+___=NaHCO3↓+NH4Cl
④NaHCO3溶于水电离的方程式___。
⑤下列说法中,正确的是___(填字母)
a.CO2可循环使用
b.副产物NH4Cl可用作肥料
c.溶液B中一定含有Na+、NH4+、Cl-
【答案】 钠熔成小球——钠与水反应放热且钠的熔点低;钠四处游动,嘶嘶作响——产生了气体;钠浮在水面上——钠的密度比水小; 碱 2Na+2H2O=2NaOH+H2↑ 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2 B Ca2++2OH-+CO2= CaCO3↓+H2O 2NaHCO3
钠熔成小球——钠与水反应放热且钠的熔点低;钠四处游动,嘶嘶作响——产生了气体;钠浮在水面上——钠的密度比水小; 碱 2Na+2H2O=2NaOH+H2↑ 2Na2O2+2H2O=4NaOH+O2↑ 2Na2O2+2CO2=2Na2CO3+O2 B Ca2++2OH-+CO2= CaCO3↓+H2O 2NaHCO3![]() Na2CO3+CO2↑+H2O Na2CO3 ①③ NaCl H2O NaHCO3=Na++HCO3- abc
Na2CO3+CO2↑+H2O Na2CO3 ①③ NaCl H2O NaHCO3=Na++HCO3- abc
【解析】
(1)根据原子核外电子排布书写原子结构示意图;Na与水发生反应:2Na+2H2O=2NaOH+H2↑,Na的密度比水小,熔点低,反应是放热反应,反应产生NaOH使溶液显碱性,据此分析解答;
(2)根据过氧化钠的性质分析;
(3)Na2CO3稳定,受热不分解,NaHCO3不稳定,受热分解产生CO2气体,CO2与澄清石灰水作用产生难溶性的碳酸钙沉淀,使石灰水变浑浊;
(4)向饱和食盐水中先通入氨气,再通入CO2气体,发生反应:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将NaHCO3过滤出来,加热发生分解反应2NaHCO3![]() Na2CO3+CO2↑+H2O,得到纯碱Na2CO3;滤液中加入NaCl固体,会析出NH4Cl晶体;
Na2CO3+CO2↑+H2O,得到纯碱Na2CO3;滤液中加入NaCl固体,会析出NH4Cl晶体;
(1)Na是11号元素,原子核外有11个电子,核外电子排布是2、8、1,所以原子结构示意图为:![]() ;
;
①钠熔成小球是由于钠与水反应放热且钠的熔点低;钠四处游动,嘶嘶作响是由于反应产生了气体;钠浮在水面上是由于钠的密度比水小;
②在③中酚酞变红,说明溶液呈碱性;
③钠与水反应的化学方程式是2Na+2H2O=2NaOH+H2↑;
(2)过氧化钠与水反应产生氢氧化钠和氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑;过氧化钠与二氧化碳反应产生碳酸钠和氧气,反应方程式为:2Na2O2+2CO2=2Na2CO3+O2;
(3)Na2CO3稳定,受热不分解,NaHCO3不稳定,受热分解产生CO2气体,反应方程式为:2NaHCO3![]() Na2CO3+CO2↑+H2O ,分解产生的CO2与烧杯中澄清石灰水作用产生难溶性的碳酸钙沉淀,使石灰水变浑浊,发生该反应的离子方程式为:Ca2++2OH-+CO2= CaCO3↓+H2O;因此加热一段时间后会看到B烧杯中澄清石灰水变浑浊;
Na2CO3+CO2↑+H2O ,分解产生的CO2与烧杯中澄清石灰水作用产生难溶性的碳酸钙沉淀,使石灰水变浑浊,发生该反应的离子方程式为:Ca2++2OH-+CO2= CaCO3↓+H2O;因此加热一段时间后会看到B烧杯中澄清石灰水变浑浊;
(4)①联合制碱法所制得的“碱”是指纯碱Na2CO3;
②在①-③所涉及的操作方法中,①为过滤;②为加热分解;③为过滤,因此包含过滤的是①③;
③根据图示,补充完整的化学方程式为:NH3+CO2 +NaCl+H2O=NaHCO3↓+NH4Cl;
④NaHCO3是弱酸的酸式盐,溶于水电离产生Na+、HCO3-,电离方程式为:NaHCO3=Na++HCO3-;
⑤a.开始通入二氧化碳反应,最后碳酸氢钠受热分解生成的CO2可循环使用,a正确;
b.副产物NH4Cl是氮肥,可用作植物生长所需的肥料,b正确;
c.溶液B中主要是氯化钠、氯化铵饱和溶液,一定含有Na+、NH4+、Cl-,c正确;
故合理选项是abc。

【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 |
| Ka=3.0×10-8 |
(1)物质的量浓度均为0.1 mol·L-1的下列四种溶液,pH由小到大排列的顺序是__________(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1 mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是__________(填字母)。
a. ![]() b.
b. ![]() c.
c. ![]()
d. ![]() e.
e. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式__________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=__________(填准确数值)。
(5)25℃时,将a mol·L-1的醋酸与b mol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为__________
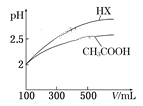
(6)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数__________(填“>”、”=”或“<”)CH3COOH的电离平衡常数。