题目内容
【题目】硅孔雀石是一种含铜的矿石,含铜形态为 CuCO3·Cu(OH)2 和 CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如图所示:
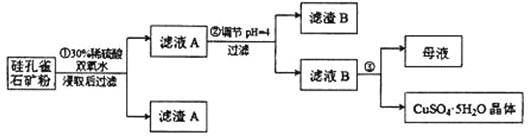
请回答下列问题;
(1)步骤①过滤所需的玻璃仪器包括烧杯、______________________。
(2)写出步骤①中在矿粉中加入30%稀硫酸时,CuSiO3·2H2O 发生反应的方程式:_______________________________________。
(3)步骤①中加入双氧水的作用是_____________________________(用离子方程式表示)
(4)步骤②中调节溶液的pH约为4,可以达到除去Fe3+而不损失CuSO4的目的,调节溶液pH可以选用的最佳试剂是_____________
A.Cu(OH)2 B.NH3·H2O C.CuO D.NaOH
(5)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH时,所得滤渣B的成分的化学式为______________
(6)步骤③将滤液B通过加热浓缩、__________、过滤等操作可得到硫酸铜晶体。
【答案】 漏斗和玻璃棒 CuSiO3·2H2O+H2SO4=CuSO4+ H2SiO3+2 H2O 2Fe2+ + H2O2+2H+ = 2Fe3++2H2O AC Fe(OH)3、Al(OH)3 冷却结晶
【解析】试题分析:由制备实验流程可知,Cu2(OH)2CO3、FeCO3、Fe2O3、Al2O3均与硫酸反应生成相应的硫酸盐,CuSiO3·2H2O与硫酸反应生成硫酸铜、硅酸沉淀,只有SiO2不反应,则滤渣a为SiO2、H2SiO3,双氧水具有氧化性将亚铁离子氧化为铁离子,所以溶液a含Cu2+、Fe3+、Al3+,体积PH=4促进Fe3+完全水解转化为沉淀,所以滤液B中主要为硫酸铜,蒸发浓缩、冷却结晶得到CuSO4![]() 5H2O。
5H2O。
解析:根据以上分析,(1)过滤所需的玻璃仪器包括烧杯、漏斗和玻璃棒。
(2)稀硫酸与CuSiO3·2H2O 发生反应生成硫酸铜、硅酸、水,方程式是CuSiO3·2H2O+H2SO4=CuSO4+ H2SiO3+2 H2O。
(3)双氧水具有氧化性将亚铁离子氧化为铁离子,离子方程式是2Fe2+ + H2O2+2H+ = 2Fe3++2H2O;
(4)步骤②中调节溶液的pH约为4,可以达到除去Fe3+而不损失CuSO4的目的,为不引入新杂质,调节溶液pH可以选用的最佳试剂是Cu(OH)2、CuO,故选AC;
(5)根据氢氧化物开始沉淀和完全沉淀的pH,调节pH=4时,Fe3+完全水解、Al3+部分水解,所以得到滤渣B的成分的化学式为Fe(OH)3、Al(OH)3;(6)滤液B中主要为硫酸铜,蒸发浓缩、冷却结晶、过滤,得到CuSO4![]() 5H2O。
5H2O。


