题目内容
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 1 mol FeI2与足量氯气反应时转移的电子数为2NA
B. 常温常压下,46gNO2和N2O4混合气体含有的原子数为3NA
C. 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子数为0.4 NA
D. 常温下56 g铁片投入足量浓H2SO4中生成NA个SO2分子
【答案】B
【解析】A、1 mol FeI2与足量Cl2反应时,Fe2+被氧化为Fe3+,I-被氧化为I2,转移电子3NA,选项A错误;B、NO2和N2O4的最简式相同,只需要计算46g NO2中原子数=![]() ×3×NA=3NA,选项B正确;C、过氧化钠与水的反应中,当生成1mol氧气时转移2mol电子,则当生成0.1mol氧气时转移0.2mol电子即0.2NA个,选项C错误;D、铁在常温下与浓硫酸发生钝化,选项D错误。答案选B。
×3×NA=3NA,选项B正确;C、过氧化钠与水的反应中,当生成1mol氧气时转移2mol电子,则当生成0.1mol氧气时转移0.2mol电子即0.2NA个,选项C错误;D、铁在常温下与浓硫酸发生钝化,选项D错误。答案选B。

【题目】硅孔雀石是一种含铜的矿石,含铜形态为 CuCO3·Cu(OH)2 和 CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如图所示:
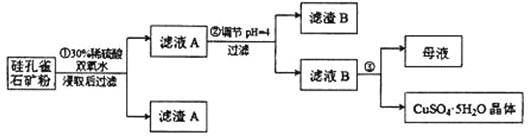
请回答下列问题;
(1)步骤①过滤所需的玻璃仪器包括烧杯、______________________。
(2)写出步骤①中在矿粉中加入30%稀硫酸时,CuSiO3·2H2O 发生反应的方程式:_______________________________________。
(3)步骤①中加入双氧水的作用是_____________________________(用离子方程式表示)
(4)步骤②中调节溶液的pH约为4,可以达到除去Fe3+而不损失CuSO4的目的,调节溶液pH可以选用的最佳试剂是_____________
A.Cu(OH)2 B.NH3·H2O C.CuO D.NaOH
(5)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
步骤②中,调节pH时,所得滤渣B的成分的化学式为______________
(6)步骤③将滤液B通过加热浓缩、__________、过滤等操作可得到硫酸铜晶体。
