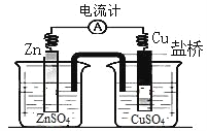
题目内容
【题目】往含Cl-和I-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。下列说法正确的是
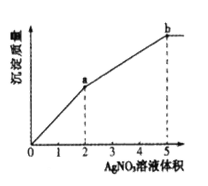
A.KSP (AgCl) < KSP (AgI)
B.c( Cl- ) :c( I-) =3:2
C.m( AgCl ) :m( AgI ) =" 2" :3
D.a~b段产生黄色沉淀
【答案】B
【解析】
氯化银相对分子质量小于碘化银,依据图象0-a、a-b段斜率可知,0-a生成的为碘化银,a-b段生成为氯化银,依据根据发生反应:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓判断原溶液中n(I-)、n(Cl-),依据消耗的硝酸银的体积判断生成m(AgCl):m(AgI),据此解答。
氯化银相对分子质量小于碘化银,依据图象0-a、a-b段斜率可知,0-a生成的为碘化银,a-b段生成为氯化银,
A.依据溶度积规则,可知向含Cl-和I-的稀溶液中滴入AgNO3溶液,先产生碘化银,说明碘化银溶解度小于氯化银,所以KSP(AgCl)>KSP(AgI),故A错误;
B.从图象可知,反应碘离子消耗硝酸银2体积,反应氯离子消耗硝酸银3体积,依据方程式:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓可知n(I-):n(Cl-),而氯离子、碘离子在同一溶液中,所以c(Cl-):c(I-)=3:2,故B正确;
C.从图象可知,反应碘离子消耗硝酸银2体积,反应氯离子消耗硝酸银3体积,依据方程式:I-+Ag+=AgI↓,Cl-+Ag+=AgCl↓可知n(I-):n(Cl-),所以生成碘化银和氯化银的物质的量之比为:n(AgCl):n(AgI)=3:2,m(AgCl):m(AgI)=3×143.5:2×162.5≠2:3,故C错误;
D.往含Cl-和I-的稀溶液中滴入AgNO3溶液,先发生I-+Ag+=AgI↓,0-a段,生成的碘化银为黄色沉淀,故D错误;
故选:B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案