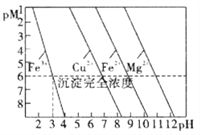
题目内容
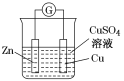
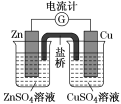
【题目】下图所示装置的叙述,正确的是( )
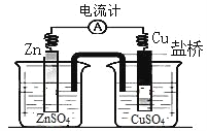
A.铜做正极,铜片上有气泡产生
B.盐桥中的阴离子会移向 CuSO4 溶液
C.正极附近的 SO![]() 浓度逐渐增大
浓度逐渐增大
D.锌片表面被氧化
【答案】D
【解析】
由图可知,该装置为双液原电池,Zn比Cu活泼,因此Zn作负极,失去电子,生成Zn2+,Cu作正极,电解质溶液中的Cu2+得到电子生成Cu,据此分析。
A. 铜做正极,电解质溶液中的Cu2+得到电子生成Cu,铜片上有红色的铜析出,A项错误;
B. 阳离子带正电荷,向正极移动,盐桥中的阳离子会移向 CuSO4 溶液,B项错误;
C. SO![]() 带负电荷,向负极移动,因此负极附近的 SO
带负电荷,向负极移动,因此负极附近的 SO![]() 浓度逐渐增大,C项错误;
浓度逐渐增大,C项错误;
D. 原电池中Zn作负极,失去电子,生成Zn2+,发生氧化反应,锌片表面被氧化,D项正确;
答案选D。
名称 | 单液原电池 | 双液原电池 |
装置 |
|
|
相同点 | 正、负极电极反应,总反应式,电极现象 | |
不同点 | 还原剂Zn与氧化剂Cu2+直接接触,既有化学能转化为电能,又有化学能转化为热能,造成能量损耗 | Zn与氧化剂Cu2+不直接接触,仅有化学能转化为电能,避免了能量损耗,故电流稳定,持续时间长 |

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目