题目内容
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中: Fe3+、Mg2+、SCN 、Cl
B.![]() =1×10-12的溶液中:K+、Na+、CO32、NO3
=1×10-12的溶液中:K+、Na+、CO32、NO3
C.![]() 的溶液中: K+、NH4+、MnO4、SO42-
的溶液中: K+、NH4+、MnO4、SO42-
D.能使甲基橙变红的溶液中: Na+、NH4+、SO42-、HCO3-
【答案】B
【解析】
A. Fe3+可与SCN 结合形成Fe(SCN)3,溶液变红色,因此,该组离子在溶液中不能大量共存,故A错误;
B. ![]() 的溶液中(OH-)=0.1mol/l,显强碱性。四种离子之间不发生反应,且它们与OH-也都不反应,所以,该组离子在指定溶液中能大量共存,故B正确;
的溶液中(OH-)=0.1mol/l,显强碱性。四种离子之间不发生反应,且它们与OH-也都不反应,所以,该组离子在指定溶液中能大量共存,故B正确;
C. Fe2+具有还原性,MnO4具有氧化性,二者可发生氧化还原反应,因此,该组离子在溶液中不能大量共存,故C错误;
D. 能使甲基橙变红色的溶液呈强酸性,HCO3-可与氢离子结合生成碳酸,碳酸不稳定,分解为二氧化碳和水,所以,该组离子在溶液中不能大量共存,故D错误。
故选B。

【题目】某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+,发现和探究过程如下。
向硝酸酸化的0.05 mol·L-1硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物
①取少量黑色固体,洗涤后,_______(填操作和现象),证明黑色固体中含有Ag。
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有_______________。
(2)针对“溶液呈黄色”,甲认为溶液中有Fe3+,乙认为铁粉过量时不可能有Fe3+,乙依据的原理是___________________(用离子方程式表示)。针对两种观点继续实验:
①取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色变浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
ⅰ | 3 | 产生大量白色沉淀;溶液呈红色 |
ⅱ | 30 | 产生白色沉淀;较3 min时量少;溶液红色较3 min时加深 |
ⅲ | 120 | 产生白色沉淀;较30 min时量少;溶液红色较30 min时变浅 |
(资料:Ag+与SCN-生成白色沉淀AgSCN)
② 对Fe3+产生的原因作出如下假设:
假设a:可能是铁粉表面有氧化层,能产生Fe3+;
假设b:空气中存在O2,由于________(用离子方程式表示),可产生Fe3+;
假设c:酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d:根据_______现象,判断溶液中存在Ag+,可产生Fe3+。
③ 下列实验Ⅰ可证实假设a、b、c不是产生Fe3+的主要原因。实验Ⅱ可证实假设d成立。
实验Ⅰ:向硝酸酸化的________溶液(pH≈2)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液,3 min时溶液呈浅红色,30 min后溶液几乎无色。
实验Ⅱ:装置如图。其中甲溶液是________,操作及现象是________________。

(3)根据实验现象,结合方程式推测实验ⅰ~ⅲ中Fe3+浓度变化的原因:______。
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了a~f6元素在周期表中的位置。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | ||||||||
二 | a | b | ||||||
三 | c | d | e | f |
回答下列问题
(1)写出a单质的电子式________。
(2)画出b的原子结构示意图:__________。
(3)写出c单质和水反应的化学方程式:__________。
(4)金属性c强于
(5)已知硒(Se)与e同主族,且位于e的下一个周期,根据硒元素在元素周期表中的位置推测硒及其化合物可能具有的性质是______。
①最高价氧化物对应的水化物的化学式为H2SeO3
②SeO2既有氧化性又有还原性
③气态氢化物的稳定性比e元素的弱
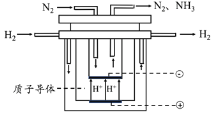
【题目】合成氨对人类的生存和发展有着重要意义,1909年哈伯在实验室中首次利用氮气与氢气反应合成氨,实现了人工固氮。
(1)反应N2(g) + 3H2(g) ![]() 2NH3(g)的化学平衡常数表达式为______。
2NH3(g)的化学平衡常数表达式为______。
(2)请结合下列数据分析,工业上选用氮气与氢气反应固氮,而没有选用氮气和氧气反
应固氮的原因是______。
序号 | 化学反应 | K(298K)的数值 |
① | N2(g) + O2(g) | 5×10-31 |
② | N2(g) + 3H2(g) | 4.1×106 |
(3)对于反应N2(g)+3H2(g)![]() 2NH3(g),在一定条件下氨的平衡含量如下表。
2NH3(g),在一定条件下氨的平衡含量如下表。
温度/℃ | 压强/MPa | 氨的平衡含量 |
200 | 10 | 81.5% |
550 | 10 | 8.25% |
① 该反应为______(填“吸热”或“放热”)反应。
② 其他条件不变时,温度升高氨的平衡含量减小的原因是______(填字母序号)。
a. 温度升高,正反应速率减小,逆反应速率增大,平衡逆向移动
b. 温度升高,浓度商(Q)变大,Q > K,平衡逆向移动
c. 温度升高,活化分子数增多,反应速率加快
d. 温度升高,K变小,平衡逆向移动
③ 哈伯选用的条件是550℃、10 MPa,而非200℃、10 MPa,可能的原因是______。
(4)一定温度下,在容积恒定的密闭容器中充入1 mol 氮气和3 mol氢气,一段时间后达化学平衡状态。若保持其他条件不变,向上述平衡体系中再充入1 mol氮气和3 mol 氢气,氮气的平衡转化率______(填“变大”“变小”或“不变”)。
(5)尽管哈伯的合成氨法被评为“20世纪科学领域中最辉煌的成就”之一,但仍存在耗能高、产率低等问题。因此,科学家在持续探索,寻求合成氨的新路径。下图为电解法合成氨的原理示意图,阴极的电极反应式为______。