题目内容
【题目】已知X、Y、Z、W为短周期元素,X的一种核素的质子数为8;Y和Ne原子的核外电子数相差1;Z的单质是一种常见的半导体材料;W的非金属性在同周期元素中最强。其原子半径随原子序数变化如图所示。
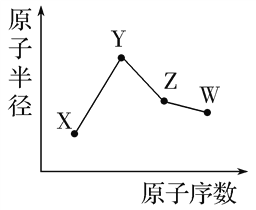
下列说法正确的是
A.对应简单离子半径:W>Y>X
B.对应气态氢化物的稳定性:Z>W
C.化合物YWX中既含离子键,又含共价键
D.Z的氧化物能与W的气态氢化物、Y的最高价氧化物对应水化物的溶液反应
【答案】C
【解析】
根据提供信息,可以推断出X为O,Y为Na,Z为Si,W为Cl。
A. 离子半径:Cl->O2->Na+,A项错误;
B. 非金属性:Si<Cl,则气态氢化物的稳定性:SiH4<HCl,B项错误;
C. NaClO中Na+与ClO-之间为离子键,ClO-中Cl与O之间为共价键,C项正确;
D. SiO2不能与HCl溶液反应,D项错误;
答案选C。

练习册系列答案
相关题目
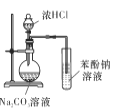
【题目】下列实验方案中,能达到相应实验目的的是
实验方案 |
|
|
|
|
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A. A B. B C. C D. D