题目内容
17.非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成: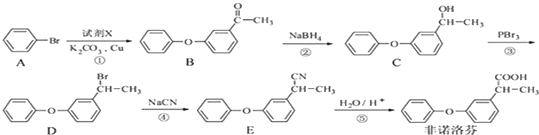
请回答下列问题:
(1)非诺洛芬中的含氧官能团为醚键和羧基(填名称).
(2)化合物A的分子式为C6H5Br.
(3)反应④的反应类型是取代反应.
(4)化合物D与NaOH醇溶液反应的方程式
 +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +NaBr+H2O.
+NaBr+H2O.(5)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应.
Ⅱ.分子中含有两个苯环,且分子中有6种不同化学环境的氢.
写出该同分异构体的结构简式:
 .
.(6)利用类似上述非诺洛芬的合成方法,写出以
 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOCH2CH3.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH$→_{浓硫酸△}^{CH_{3}COOH}$CH3COOCH2CH3.
分析 根据流程图中,A发生取代反应生成B,B发生还原反应生成C,C发生取代反应生成D,D发生取代反应生成E,E发生水解反应生成F,
(1)据非诺洛芬的结构简式确定官能团名称;
(2)据A的结构简式确定A的分子式;
(3)根据反应物和生成物变化确定反应类型;
(4)化合物D与NaOH的醇溶液发生消去反应;
(5)据B的结构简式和题给信息确定其同分异构体;
(6) 与HBr发生取代反应生成
与HBr发生取代反应生成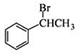 ,
, 和NaCN反应后再水解生成
和NaCN反应后再水解生成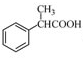 .
.
解答 解:(1)该物质中的官能团是醚键和羧基,故答案为:醚键;羧基;
(2)据结构简式可知,其分子式为C6H5Br,故答案为:C6H5Br;
(3)D发生取代反应生成E,故答案为:取代反应;
(4)D为 ,在NaOH的醇溶液中发生消去反应生成
,在NaOH的醇溶液中发生消去反应生成 ,反应方程式为,
,反应方程式为, +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +NaBr+H2O,
+NaBr+H2O,
故答案为: +NaOH$→_{△}^{乙醇}$
+NaOH$→_{△}^{乙醇}$ +NaBr+H2O;
+NaBr+H2O;
(5)B含有2个苯环和2个C原子、2个O原子,其同分异构体能发生银镜反应,说明含有醛基,其水解产物之一能与FeCl3溶液发生显色反应说明含有酚羟基形成的酯基,
分子中含有两个苯环,且分子中有6种不同化学环境的氢的同分异构体为 ,
,
故答案为: ;
;
(6) 与HBr发生取代反应生成
与HBr发生取代反应生成 ,
, 和NaCN反应后再水解生成
和NaCN反应后再水解生成 ,故答案为:
,故答案为: $\stackrel{HBr}{→}$
$\stackrel{HBr}{→}$ $\stackrel{Nacn}{→}$
$\stackrel{Nacn}{→}$ $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$ .
.
点评 本题考查了有机物的合成,明确有机物中含有的官能团及其性质是解本题关键,利用题给信息解答(6)题,注意反应条件和有机物断键和成键位置,题目难度中等.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
8.下列方法或操作正确且能达到预期目的是( )
| 序号 | 实验目的 | 方法及操作 |
| ① | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| ② | 鉴别二甲醚和乙醇 | 利用质谱法 |
| ③ | 检验乙醇在浓硫酸催化下的消去产物 | 将产物通入酸性KMnO4溶液 |
| ④ | 检验溴乙烷中的溴元素 | 将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,再滴加AgNO3溶液 |
| ⑤ | 鉴别苯、四氯化碳、丙醛 | 分别滴加溴水 |
| A. | ①⑤ | B. | ②③ | C. | ①④⑤ | D. | ②③④ |
5.下列有关溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1 mol•L-1NH4Cl溶液与0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液与0.1 mol•L-1NaHCO3溶液等体积混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液与0.1 mol•L-1HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+). |
2.H、Al、O、N、S是常见的六种元素
(1)S位于元素周期表三周期第VIA族,Fe的基态原子核外价电子排布式为3d64s2(或1s22s22p63s23p63d64s2);O的基态原子核外有8种运动状态不同的电子
(2)用“>”“<”或“=”填空
(3)己知:下列两个热化学方程式:
4Fe(s)+302(g)=2Fe2O3(s)△H=-aKJ/mol
4Al(s)+3O2(g)=2Al2O3(S)△H=-bKJ/mol
則Al(s)的单质和Fe2O3(s)反应的热化学方程式是Fe2O3(s)+2Al(s)=Al2O3(s)+2Fe(s)△H=-$\frac{1}{2}$(b-a)KJ•mol-1
(4)FeSO4溶液可与硝酸发生反应,写出此反应的离子方程式,并标出电子转移的方向和数目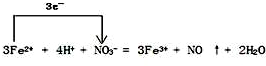 .
.
(1)S位于元素周期表三周期第VIA族,Fe的基态原子核外价电子排布式为3d64s2(或1s22s22p63s23p63d64s2);O的基态原子核外有8种运动状态不同的电子
(2)用“>”“<”或“=”填空
| 第一电离能 | 氧化性 | 沸点 | 非金属性 |
| N>S | Fe3+>Al3+ | NH3<H2O | 16O=18O |
4Fe(s)+302(g)=2Fe2O3(s)△H=-aKJ/mol
4Al(s)+3O2(g)=2Al2O3(S)△H=-bKJ/mol
則Al(s)的单质和Fe2O3(s)反应的热化学方程式是Fe2O3(s)+2Al(s)=Al2O3(s)+2Fe(s)△H=-$\frac{1}{2}$(b-a)KJ•mol-1
(4)FeSO4溶液可与硝酸发生反应,写出此反应的离子方程式,并标出电子转移的方向和数目
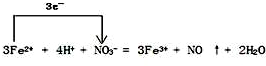 .
.
9.制备Fe3O4纳米颗粒的化学方程式为:3Fe2++2S2O32-+O2+4OH-=Fe3O4+X+2H2O.下列有关说法不正确的是( )
| A. | 上式中的X为S4O62- | |
| B. | 该反应中的还原剂为Fe2+和S2O32- | |
| C. | 当3 mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1 mol | |
| D. | 当生成1 mol Fe3O4时,转移电子的物质的量为4 mol |
6.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 同温同压同体积的CO2和SO2所含氧原子数均为2NA | |
| B. | 25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 0.10molFe粉与足量水蒸气反应生成的H2分子数为0.10NA | |
| D. | 1L1.0mol•L-1NH4Cl与2L 0.5mol•L-1NH4Cl溶液含NH4+数目相同 |
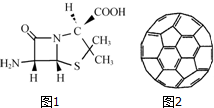 在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、含铬物质等.
在人类文明的历程中,许多物质发挥过重要作用,如铁、硝酸钾、青霉素、聚乙烯、二氧化硅、富勒烯、含铬物质等.