��Ŀ����
����Ŀ����������(SOCl2)�����Ȼ���������һ��Һ̬�ķǵ���ʣ��е�Ϊ77�棬SOCl2����Ԫ������Ԫ��ֱ���Թ��ۼ�����������C1��-1��, SOCl2��ˮ�����ҷ�Ӧ��Һ�����������γɣ����д��̼�����ζ�������ݳ����������ʹƷ����Һ��ɫ�����Ⱥ���ɫ�ָ�����ش��������⣺
I.����MgCl2��Һ���ܵõ���ˮMgCl2������SOC12��MgCl2��6H2O��ϲ����ȣ����Ƶ���ˮMgCl2������SOC12��ˮ��Ӧ�ķ���ʽ�ͱ�Ҫ����������ԭ��____________��
II. ��1 L 0.1 mol��L-1��Ba(OH)3��Һ�е���SOCl2��ʼʱ������ɫ��������������SOCl2���������ְ�ɫ�������ܽ⡣
(1)���ְ�ɫ��������ӷ���ʽΪ__________________��
(2)��ɫ�����ܽ�����з�����Ӧ��BaSO3+ H+==Ba2++HSO3-����������ȫ�ܽ�ʱ�����Һ��pH=3�����Ե���SOCl2�����������Һ�е�c(HSO3-)=_______��(H2SO4: Ka1=1.5��10-5��Ka2=1.0��10-7��BaSO3:Kap=5.0��10-7)
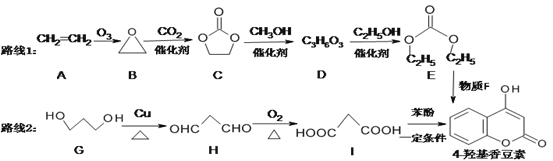
III.��ҵ�ϣ����������������·�Ӧ�Ƶã�
i.SO3(g)+SCl2(g) ![]() SOCl2(g)+SO2(g) ��H1=+302 kJ��mol-1
SOCl2(g)+SO2(g) ��H1=+302 kJ��mol-1
ii.SO2(g)+PCl5(g) ![]() SOCl2(g)+POCl3(g) ��H2=-268kJ��mol-1
SOCl2(g)+POCl3(g) ��H2=-268kJ��mol-1
(1)��֪�������л�ѧ���ļ������±���ʾ��

�����x=________________��
(2)��1 L�ݻ��㶨���ܱ������г���1.0molPCl5(g)��1.0mol SO3(g)��1.0 mol SCl2(g),��������������Ӧ��������������ʱ����ϵ��SO2��ƽ������������¶�(T)�Ĺ�ϵ��ͼ��ʾ��
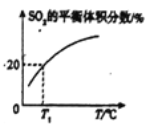
�������¶ȵ����ߣ�SO2��ƽ��������������ԭ��Ϊ_________��
��T1��ʱ�����ƽ����ϵ��SO3�����ʵ���Ϊ0.2 mol������¶���,PCl5��ƽ��ת����Ϊ______����ӦI��ƽ�ⳣ����ֵΪ__________��
���𰸡� SOCl2+H2O==SO2��+2HCl������SOCl2��ͨ�룬�ܹ�����MgCl2 6H2O�ֽ������ˮ��ͬʱ���ɵ�HCl������ MgCl2��ˮ�� Ba2++4OH-+SOCl2==BaSO3��+2Cl-+2H2O 0.05 mol��L-1 362 ��ӦiΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���SO2��ƽ�������������ӦiiΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���SO2��ƽ���������Ҳ���� 20% 15
�����������������������Ҫ���黯ѧƽ�⡣
I.����MgCl2��Һ���ܵõ���ˮMgCl2������SOC12��MgCl2��6H2O��ϲ����ȣ����Ƶ���ˮMgCl2��������ΪSOCl2+H2O==SO2��+2HCl������SOCl2��ͨ�룬�ܹ�����MgCl2 6H2O�ֽ������ˮ��ͬʱ���ɵ�HCl������ MgCl2��ˮ�⡣
II. (1)���ְ�ɫ��������ӷ���ʽΪBa2++4OH-+SOCl2==BaSO3��+2Cl-+2H2O��
(2) BaSO3:Kap=5.0��10-7=c(Ba2+)c(SO32-), c(Ba2+)= c[Ba(OH)3)]= 0.1 mol��L-1���ɵ�c(SO32-)= 5.0��10-6 mol��L-1��
Ka2=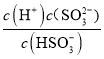 =1.0��10-7����c(SO32-)= 5.0��10-6mol��L-1��c(H+)=1��10-3 mol��L-1����ɵ�
=1.0��10-7����c(SO32-)= 5.0��10-6mol��L-1��c(H+)=1��10-3 mol��L-1����ɵ�
c(HSO3-)=0.05 mol��L-1 ��
III.(1) ��H2=��Ӧ�����֮��-���������֮��=(364��2+331��5-585-320��3-382-2x) kJ��mol-1
=-268kJ��mol-1��x=362��
(2)�������¶ȵ����ߣ�SO2��ƽ��������������ԭ��Ϊ����ӦiΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���SO2��ƽ�������������ӦiiΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���SO2��ƽ���������Ҳ����
��T1��ʱ����ʼ����1.0mol SO3(g)�����ƽ����ϵ��SO3�����ʵ���Ϊ0.2 mol����ͼ��֪ƽ����ϵ��SO2�����ʵ���Ϊ3mol��20%=0.6mol��
i.SO3(g)+SCl2(g) ![]() SOCl2(g)+SO2(g)
SOCl2(g)+SO2(g)
��ʼ���ʵ���/mol 1.0 1.0 0 0
�仯���ʵ���/mol 0.8 0.8 0.8 0.8
ƽ�����ʵ���/mol 0.2 0.2 0.8 0.8
ii.SO2(g)+PCl5(g) ![]() SOCl2(g)+POCl3(g)
SOCl2(g)+POCl3(g)
��ʼ���ʵ���/mol 0.8 1.0 0 0
�仯���ʵ���/mol 0.2 0.2 0.2 0.2
ƽ�����ʵ���/mol 0.6 0.8 0.2 0.2
����¶���,PCl5��ƽ��ת����Ϊ20%��
��Ӧi��iiͬʱ����ƽ��ʱ��SO3��SCl2��SOCl2��SO2��Ũ�ȷֱ���0.2mol/L��0.2mol/L��1.0mol/L��0.6mol/L��ƽ�ⳣ����ֵΪ(1.0��0.6)/(0.2��0.2)=15.