题目内容
【题目】某硫酸盐在工农业生产上有广泛用途。它的组成可表达为KxFey(SO4)z·nH2O(其中Fe为+2价)。为测定它的组成可通过下列实验:
步骤Ⅰ:称取22.80 g样品,配制成100.00 mL溶液A。
步骤Ⅱ:量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点(滴定过程中MnO4-与Fe2+反应生成Mn2+和Fe3+),消耗KMnO4溶液10.00 mL。
步骤Ⅲ:量取25.00 mL溶液A,加入足量的四苯硼酸钠{Na[B(C6H5)4]}溶液至沉淀完全,得白色固体四苯硼酸钾(摩尔质量为358 g·mol-1)10.74 g。该反应的离子方程式为K++[B(C6H5)4]-=K[B(C6H5)4]↓。
(1)判断步骤Ⅱ滴定终点的现象是________,写出步骤Ⅱ中的离子反应方程式:________。
(2)已知常温下K[B(C6H5)4]的Ksp=2.0×10-13,欲使溶液中c(K+)≤1.0×10-5 mol·L-1,此时溶液中c{[B(C6H5)4]-}≥________mol·L-1。
(3)通过计算确定样品的化学式__________(写出计算过程)。
【答案】溶液由无色变为(浅)红色且半分钟不变色 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 2.0×10-8 溶液中n(K+)=![]() ×4=0.12mol,n(Fe2+)=0.300 0 mol·L-1×0.01L×5×4=0.06mol,根据电荷守恒可知n(K+)+2n(Fe2+)=2n(SO42-)可得n(SO42-)=
×4=0.12mol,n(Fe2+)=0.300 0 mol·L-1×0.01L×5×4=0.06mol,根据电荷守恒可知n(K+)+2n(Fe2+)=2n(SO42-)可得n(SO42-)=![]() =
=![]() =0.12mol,根据样品的质量可计算出结晶水的物质的量n(H2O)=
=0.12mol,根据样品的质量可计算出结晶水的物质的量n(H2O)=![]() =0.18mol,因此n(K+):n(Fe2+):n(SO42-):n(H2O)=0.12:0.06:0.12:0.18=2:1:2:3,所以化学式为K2Fe (SO4)2·3H2O
=0.18mol,因此n(K+):n(Fe2+):n(SO42-):n(H2O)=0.12:0.06:0.12:0.18=2:1:2:3,所以化学式为K2Fe (SO4)2·3H2O
【解析】
(1)量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点,其中高锰酸钾溶液可做指示剂,自身为紫色,达到滴定终点时,因发生了氧化还原反应而使其颜色发生了变化;滴定过程中MnO4-与Fe2+反应生成Mn2+和Fe3+,发生了氧化还原反应,根据氧化还原反应的规律书写离子方程式;
(2)根据Ksp{K[B(C6H5)4]}= c(K+) c{[B(C6H5)4]-}进行计算;
(3)量取25.00 mL溶液A,加入足量的四苯硼酸钠{Na[B(C6H5)4]}溶液至沉淀完全,得白色固体四苯硼酸钾(摩尔质量为358 g·mol-1)10.74 g,可知100.00 mL溶液中含K+的物质的量n(K+)=![]() ×4=0.12mol;量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液10.00 mL,可知100.00 mL溶液中n(Fe2+)=0.300 0 mol·L-1×0.01L×5×4=0.06mol,根据电荷守恒可计算出溶液中SO42-的物质的量,再根据样品的质量计算出结晶水的质量,最终可确定各离子和水的物质的量之比,进而确定化学式。
×4=0.12mol;量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液10.00 mL,可知100.00 mL溶液中n(Fe2+)=0.300 0 mol·L-1×0.01L×5×4=0.06mol,根据电荷守恒可计算出溶液中SO42-的物质的量,再根据样品的质量计算出结晶水的质量,最终可确定各离子和水的物质的量之比,进而确定化学式。
(1)量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点,其中高锰酸钾溶液可做指示剂,自身为紫色,达到滴定终点时,溶液由无色变为(浅)红色且半分钟不变色;滴定过程中MnO4-与Fe2+反应生成Mn2+和Fe3+,发生了氧化还原反应,离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(2)因Ksp{K[B(C6H5)4]}= c(K+) c{[B(C6H5)4]-},那么c{[B(C6H5)4]-}=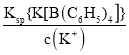 =
=![]() =2.0×10-8 mol·L-1,因此当溶液中c(K+)≤1.0×10-5 mol·L-1时,溶液中c{[B(C6H5)4]-}≥2.0×10-8mol·L-1。
=2.0×10-8 mol·L-1,因此当溶液中c(K+)≤1.0×10-5 mol·L-1时,溶液中c{[B(C6H5)4]-}≥2.0×10-8mol·L-1。
(3)量取25.00 mL溶液A,加入足量的四苯硼酸钠{Na[B(C6H5)4]}溶液至沉淀完全,得白色固体四苯硼酸钾(摩尔质量为358 g·mol-1)10.74 g,可知100.00 mL溶液中含K+的物质的量n(K+)=![]() ×4=0.12mol;量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液10.00 mL,可知100.00 mL溶液中n(Fe2+)=0.300 0 mol·L-1×0.01L×5×4=0.06mol,根据电荷守恒可知n(K+)+2n(Fe2+)=2n(SO42-),那么n(SO42-)=
×4=0.12mol;量取25.00 mL溶液A,用0.300 0 mol·L-1酸性KMnO4溶液滴定至终点,消耗KMnO4溶液10.00 mL,可知100.00 mL溶液中n(Fe2+)=0.300 0 mol·L-1×0.01L×5×4=0.06mol,根据电荷守恒可知n(K+)+2n(Fe2+)=2n(SO42-),那么n(SO42-)=![]() =
=![]() =0.12mol,进一步可知n(H2O)=
=0.12mol,进一步可知n(H2O)=![]() =0.18mol,因此n(K+):n(Fe2+):n(SO42-):n(H2O)=0.12:0.06:0.12:0.18=2:1:2:3,所以化学式为K2Fe (SO4)2·3H2O。
=0.18mol,因此n(K+):n(Fe2+):n(SO42-):n(H2O)=0.12:0.06:0.12:0.18=2:1:2:3,所以化学式为K2Fe (SO4)2·3H2O。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案