题目内容
【题目】(1)NH4Al(SO4)2可作净水剂,其理由是__________________(用必要的化学用语和相关文字说明).
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+) B.![]()
C.c(H+)·c(OH-) D.![]()
E.![]()
若该溶液升高温度,上述5种表达式的数据一定增大的是___________。
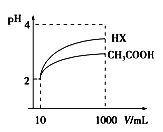
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000mL,稀释过程pH变化如图:则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是____________________;稀释后,HX溶液中由水电离出来的c(H+)___________(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+)。
(4)已知25℃,NH3·H2O的Kb=1.8×105,H2SO3的Ka1=1.3×102,Ka2=6.2×108。将SO2通入该氨水中,当c(OH)降至1.0×107 mol·L1时,溶液中的![]() =____________。
=____________。
(5)①25℃时,Ka(HCN)=4.9×l0-10,Ka(CH3COOH)=1.8×l0-5,H2CO3:K1=4.3×l0-7、K2=5.6×l0-11,25℃时有pH相等的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的物质的量浓度由大到小的顺序为_____________.
②向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:_______________.
【答案】Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3+ + 3H2O![]() Al(OH)3 (胶体)+ 3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水 A ABCE 大于 稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大 大于 0.62 CH3COONa溶液>NaCN溶液>Na2CO3溶液 NaCN+H2O+CO2=HCN+NaHCO3
Al(OH)3 (胶体)+ 3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水 A ABCE 大于 稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大 大于 0.62 CH3COONa溶液>NaCN溶液>Na2CO3溶液 NaCN+H2O+CO2=HCN+NaHCO3
【解析】
(1)NH4Al(SO4)2可作净水剂,其理由是Al3+水解生成Al(OH)3胶体,吸附水中的悬浮颗粒物,从而使其沉降。
(2) CH3COOH![]() CH3COO-+H+,在加水稀释过程中,c(CH3COOH)、c(CH3COO-)、c(H+)都减小,但c(OH-)增大。由此可分析各表达式,确定一定变小的选项。
CH3COO-+H+,在加水稀释过程中,c(CH3COOH)、c(CH3COO-)、c(H+)都减小,但c(OH-)增大。由此可分析各表达式,确定一定变小的选项。
若该溶液升高温度,则醋酸的电离平衡、水的电离平衡都向正反应方向移动,c(CH3COOH)减小,c(CH3COO-)、c(H+)、c(OH-)都增大,由此可判断5种表达式的数据一定增大的选项。
(3)从图中可以看出,HX的pH变化的幅度大,则HX的酸性较强,HX的电离平衡常数大;稀释后,HX溶液的pH大,则水的电离程度大,电离产生的c(H+)大。
(4)将SO2通入该氨水中,当c(OH)=1.0×107 mol·L1时,c(H+)=1.0×107 mol·L1,由HSO3-![]() H++SO32-可得,Ka2=
H++SO32-可得,Ka2=![]() ,
,![]() =
=![]() ,代入数据,即可求出结果。
,代入数据,即可求出结果。
(5)①酸的电离常数越大,越易发生电离,它的酸根离子越难发生水解,则水解生成相同浓度的OH-,所需酸根离子的浓度越大。从而可得出pH相等的NaCN溶液、Na2CO3溶液、CH3COONa溶液的物质的量浓度由大到小的顺序。
②向NaCN溶液中通入少量CO2,因为4.9×l0-10>5.6×l0-11,所以H2CO3只能转化为HCO3-。
(1)NH4Al(SO4)2可作净水剂,其理由是Al3+水解生成Al(OH)3胶体,吸附水中的悬浮颗粒物,从而使其沉降。答案为:Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3+ + 3H2O![]() Al(OH)3 (胶体)+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;
Al(OH)3 (胶体)+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水;
(2) CH3COOH![]() CH3COO-+H+,在加水稀释过程中,c(CH3COOH)、c(CH3COO-)、c(H+)都减小,但c(OH-)增大。
CH3COO-+H+,在加水稀释过程中,c(CH3COOH)、c(CH3COO-)、c(H+)都减小,但c(OH-)增大。
A.醋酸加水稀释,虽然电离产生的H+数目增多,但溶液体积增大占主导地位,所以c(H+)减小;
B.![]() =
=![]() ,加水稀释,n(CH3COOH)减小,n(H+)
,加水稀释,n(CH3COOH)减小,n(H+)
C.c(H+)·c(OH-)=Kw,温度不变时,Kw不变;
D.![]() ,加水稀释过程中,c(H+)减小,c(OH-)增大,所以比值增大;
,加水稀释过程中,c(H+)减小,c(OH-)增大,所以比值增大;
E.![]() =Ka,温度不变时,Ka不变。答案为:A;
=Ka,温度不变时,Ka不变。答案为:A;
若该溶液升高温度,则醋酸的电离平衡、水的电离平衡都向正反应方向移动,c(CH3COOH)减小,c(CH3COO-)、c(H+)、c(OH-)都增大。
A.水的电离程度增大,所以c(H+)增大;
B.![]() ,升高温度,平衡正向移动,c(CH3COOH)减小,c(H+)增大,所以比值增大;
,升高温度,平衡正向移动,c(CH3COOH)减小,c(H+)增大,所以比值增大;
C.c(H+)·c(OH-)=Kw,温度升高,Kw增大;
D.![]() ,升高温度,c(H+)增大,c(OH-)增大,但H+主要来自醋酸电离,所以c(H+)增大更多,比值减小;
,升高温度,c(H+)增大,c(OH-)增大,但H+主要来自醋酸电离,所以c(H+)增大更多,比值减小;
E.![]() =Ka,温度升高时,Ka增大。答案为:ABCE;
=Ka,温度升高时,Ka增大。答案为:ABCE;
(3)从图中可以看出,HX的pH变化的幅度大,则HX的酸性较强,HX的电离平衡常数大于醋酸的平衡常数;稀释后,HX溶液的pH大,则水的电离程度大,水电离产生的c(H+)大,所以HX溶液中由水电离出来的c(H+)大于醋酸溶液中由水电离出来的c(H+)。答案为:大于;稀释相同倍数,HX的pH变化比CH3COOH的大,酸性强,电离平衡常数大;大于;
(4)将SO2通入该氨水中,当c(OH)=1.0×107 mol·L1时,c(H+)=1.0×107 mol·L1,由HSO3-![]() H++SO32-可得,Ka2=
H++SO32-可得,Ka2=![]() ,
,![]() =
=![]() =
=![]() =0.62。答案为:0.62;
=0.62。答案为:0.62;
(5)①酸的电离常数越大,越易发生电离,它的酸根离子越难发生水解,则水解生成相同浓度的OH-,所需酸根离子的浓度越大。从而可得出pH相等的NaCN溶液、Na2CO3溶液、CH3COONa溶液的物质的量浓度由大到小的顺序为CH3COONa溶液>NaCN溶液>Na2CO3溶液。答案为:CH3COONa溶液>NaCN溶液>Na2CO3溶液;
②向NaCN溶液中通入少量CO2,因为4.9×l0-10>5.6×l0-11,所以H2CO3只能转化为HCO3-,化学方程式为NaCN+H2O+CO2=HCN+NaHCO3。答案为:NaCN+H2O+CO2=HCN+NaHCO3。

 阅读快车系列答案
阅读快车系列答案