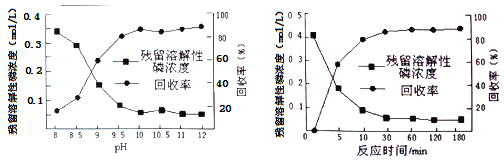
��Ŀ����
����Ŀ����������100mL0.2mol/L�İ�ˮ����μ���0.2mol/L�����ᣬ������Һ��NH4+��NH3��H2O�����ʵ����������������������V�����ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����

A. ��ʾNH3��H2O���ʵ��������仯��������B
B. pH=9.26ʱ����Һ�У�NH3��H2O�ĵ���̶�С��NH4+��ˮ��̶�
C. ������,NH3��H2O�ĵ��볣��Ϊ1.8��10-5mol/L(��֪lg1.8=0.26)
D. �������������Ϊ50mLʱ����Һ��c(NH4+)-c(NH3��H2O)=2��(10-5+10-9)mol/L
���𰸡�C
��������NH3��H2O��HCl�ܹ�������Ӧ�� NH3��H2O+HCl=NH4Cl+H2O������HCl�ĵ��룬NH3��H2OŨ����С��NH4+��Ũ����������������B��ʾ����NH4+������NH3��H2O�����ʵ���������Aѡ�����pH=9.26ʱ����Һ�ʼ��ԣ�˵��NH3��H2O�ĵ���̶ȴ���NH4+���ӵ�ˮ��̶ȣ�Bѡ�����NH3��H2O![]() NH4++ OH-��K=��C��NH4+����C��OH-����/C��NH3��H2O��������ͼʾ�ã���PH=9.26ʱ����Һ��NH3��H2O��NH4+�����ʵ���������ͬ����Ũ����ͬ������K=C��OH-��=Kw/C��H+��=1��10-14/10-9.26=10-4.74=1.8��10-5��Cѡ����ȷ���������������Ϊ50mLʱ��C��Cl-��=1/15mol��L-1��C(NH3��H2O)+C(NH4+)=2/15 molL-1,�����У�2C(Cl-)= C(NH3��H2O)+C(NH4+),���ݵ���غ���2C(H+)+2C(NH4+) =2C��Cl-��+2C��OH-��������c(NH4+)-c(NH3��H2O)=2��(10-5-10-9)mol/L��Dѡ�������ȷ����C��
NH4++ OH-��K=��C��NH4+����C��OH-����/C��NH3��H2O��������ͼʾ�ã���PH=9.26ʱ����Һ��NH3��H2O��NH4+�����ʵ���������ͬ����Ũ����ͬ������K=C��OH-��=Kw/C��H+��=1��10-14/10-9.26=10-4.74=1.8��10-5��Cѡ����ȷ���������������Ϊ50mLʱ��C��Cl-��=1/15mol��L-1��C(NH3��H2O)+C(NH4+)=2/15 molL-1,�����У�2C(Cl-)= C(NH3��H2O)+C(NH4+),���ݵ���غ���2C(H+)+2C(NH4+) =2C��Cl-��+2C��OH-��������c(NH4+)-c(NH3��H2O)=2��(10-5-10-9)mol/L��Dѡ�������ȷ����C��

����Ŀ��NaF��NaI��MgO��Ϊ���ӻ���������������ݣ����ж������ֻ�������۵�ߵ�˳��
���� | ��NaF | ��NaI | ��MgO |
���ӵ���� | 1 | 1 | 2 |
������10��10m�� | 2.31 | 3.18 | 2.10 |
A.�٣��ڣ���B.�ۣ��٣���C.�ۣ��ڣ���D.�ڣ��٣���