题目内容
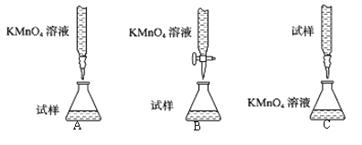
【题目】SO2可用作红酒的防腐剂,下列关于SO2的叙述不正确的是
A.能使酸性KMnO4溶液褪色B.能使品红溶液褪色
C.能与NaOH溶液反应D.能与水反应生成硫酸
【答案】D
【解析】
A.SO2有还原性,能使KMnO4溶液褪色,A正确;
B.SO2有漂白性,能使品红溶液褪色,B正确;
C.SO2是酸性氧化物,能与NaOH溶液反应生成亚硫酸钠和水,C正确;
D.SO2与水反应生成亚硫酸,而不是硫酸,D错误。
答案选D。

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案【题目】甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。
(1)已知反应CO(g)+2H2(g)== CH3OH(g) H= —99kJ.mol—1中的相关化学键键能如下:
化学键 | H-H | C-O | C≡O | H-O | C-H |
E/(kJ.mol-1) | 436 | 343 | x | 465 | 413 |
则x=___________________。
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)![]() CH3OH(g) ,
CH3OH(g) ,
CO在不同温度下的平衡转化率(α)与压强的关系如图所示。
①a、b两点的反应速率:v(b)____v(a)(填“>”、“<”或“=”)。②该反应的△S______0,图中的T1______T2(填“>”、“<”或“=”)。
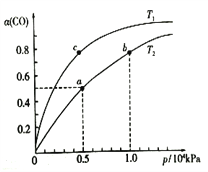
③该合成反应的温度一般控制在240~270℃,选择此温度范围的原因是:
I.此温度范围下的催化剂活性高;
II.______________________________________________________。
④图中a点的压强平衡常数KP=_______________(KPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)利用合成气(主要成分为CO和H2)合成甲醇,发生主要反应如下:
I:CO(g)+2H2(g)![]() CH3OH(g) H1
CH3OH(g) H1
II:CO2(g)+H2(g) ![]() CO(g) + H2O(g) H2
CO(g) + H2O(g) H2
III:CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g) H3
CH3OH(g) + H2O(g) H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化曲线如下图所示。
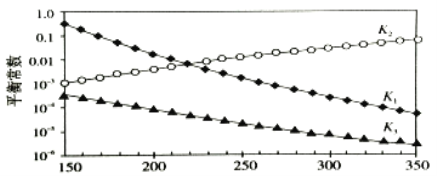
则H1___________H3(填“>”、“<”或“=”), 理由是__________________________。
【题目】利用水钴矿[主要成分为Co2O3和Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)提高水钴矿浸出速率的措施有_______________________________________(填写两点),浸出过程中Co2O3发生反应的离子方程式为________________________。
(2)NaClO3的作用是_________________________________。
(3)加Na2CO3调pH至5.2所得沉淀为_________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是___________________________________________;其使用的适宜pH范围是______________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(5)由萃取后余液获得粗产品的操作步骤为_____________。