题目内容
【题目】含磷化合物在生产生活中有着重要的应用。
(1)磷与氨是同主族元素,下列能说明者非金属性强弱的是_______(填字母)。
a.NH3比PH3稳定性强
b.常温下,氮气为气体,磷单质为固体
c.氮气与氢气化合比磷与氢气化合更困难
d.HNO3的酸性比HPO3酸性强
(2)工业常用磷精矿[Ca5(PO4)3F]和硫酸反应制各磷酸。己知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5CaO(s)+3H3PO4(l)+HF(g)=Ca5(PO4)F(s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)F和硫酸反应制备磷酸的热化学方程式为________________。
(3)已知PCl5(g)![]() PCl3(g)+Cl2(g)△H>0。温度为T时,把一定量的PCl5气体引入一真空瓶内,反应达平衡后PCl5与PCl3的分压之比为1:3(分压一总压×物质的量分数)。
PCl3(g)+Cl2(g)△H>0。温度为T时,把一定量的PCl5气体引入一真空瓶内,反应达平衡后PCl5与PCl3的分压之比为1:3(分压一总压×物质的量分数)。
①PCl5的分解率a1=_____%。若达到兴衡后体系总压为1.4MPa,用平衡分压代替平衡浓度表示反应的平衡常数Kp=_________。
②温度为T2时,新的平衡体系中PCl5与Cl2分压相同,则PCl5的分解率a1________a2,温度T1___T2(填“>”“<”或“=”)。
③达到平衡后,下列情况使PCl5分解率增大的是___________(填字母)。
a.温度、体积不变,充入氩气 b.体积不变,对体系加热
C.温度、体积不变,充入氯气 d.温度不变,增大容器体积
(4)氧化水解法产三氯氧磷的废水中主要含有H3PO4、H3PO3等,可先加入适量漂白粉,再加入生石灰调节pH将磷元素转化为磷酸的钙盐沉淀并回收。
①在沉淀前先加入适量漂白粉的作用是__________________。
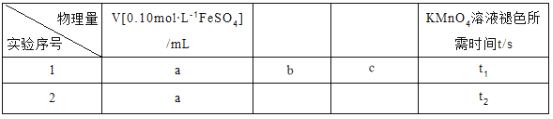
②下图是不同条件对磷的沉淀回收率的影响图像。处理该厂废水需控制的工艺条件为______。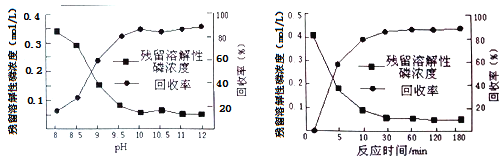
【答案】 a Ca5(PO4)3F(s) +5H2SO4(l)=5CaSO4(s)+3H3PO4(l)+HF(g) △H=﹣418kJ· mol-1 75 1.8MPa > > bd 将废水中的H3PO3氧化成H3PO4 溶液pH>10,反应时间>30min
【解析】(1)同主族元素从上到下原子序数逐渐增大,元素金属性逐渐增大,非金属性逐渐减小,单质与氢气的化合越来越难,气态氢化物稳定性逐渐减小,最高价氧化物对应的水化物的酸性逐渐减弱,所以NH3比PH3稳定性强可以说明非金属性N>P,a可以;常温下,氮气为气体,磷单质为固体是它们的物理性质,不能说明非金属性N>P,b不可以;氮气与氢气化合比磷与氢气化合更困难可以说明非金属性P>N,与元素周期律矛盾,c不可以;HPO3不是磷元素的最高价氧化物对应的水化物,所以HNO3与HPO3酸性强弱不能说明N与P非金属性强弱,d不可以;正确答案是a;
(2)根据盖斯定律:将CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol乘以5倍减去
5CaO(s)+3H3PO4(l)+HF(g)=Ca5(PO4)F(s)+5H2O(l) △H=-937kJ/mol得到:Ca5(PO4)3F(s) +5H2SO4(l)=5CaSO4(s)+3H3PO4(l)+HF(g) △H=﹣418kJ· mol-1,所以Ca5(PO4)F和硫酸反应制备磷酸的热化学方程式为:Ca5(PO4)3F(s) +5H2SO4(l)=5CaSO4(s)+3H3PO4(l)+HF(g) △H=﹣418kJ· mol-1;
(3) 假设一定量的PCl5为amol,压强是P0
PCl5(g)![]() PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
开始(mol) a 0 0
转化(mol) x x x
平衡(mol) a-x x x
根据:分压=总压×物质的量分数,达平衡后P(总)=(a+x)P0/a,P(PCl5)=(a-x)P(总)/(a+x), P(Cl2)= P(PCl3)=xP(总)/(a+x),根据反应达平衡后PCl5与PCl3的分压之比为1:3得出:x=3a/4;
① PCl5的分解率a1=x/a=75% , 平衡分压代替平衡浓度表示反应的平衡常数表达式是:Kp=P(Cl2)P(PCl3)/P(PCl5),将P(总)=1.4MPa代入得:Kp=1.8MPa
② 根据①的计算数据可知,在原平衡中,P(PCl5)<P(Cl2),新平衡中两者相同,说明平衡逆向移动,根据反应方程式:PCl5(g)![]() PCl3(g)+Cl2(g)△H>0,该反应正反应是吸热反应,平衡逆向移动,说明温度降低,即T2<T1,新平衡与原平衡相比,PCl5分解率降低了,所以正确答案是:a1>a2,温度T1>T2;
PCl3(g)+Cl2(g)△H>0,该反应正反应是吸热反应,平衡逆向移动,说明温度降低,即T2<T1,新平衡与原平衡相比,PCl5分解率降低了,所以正确答案是:a1>a2,温度T1>T2;
③ PCl5(g)![]() PCl3(g)+Cl2(g)△H>0达到平衡后,温度、体积不变,充入氩气,反应物、生成物的浓度都没有改变,平衡不移动,a不能使PCl5分解率增大,a选项错误;体积不变,对体系加热,相当于升高温度,该反应的正反应是吸热反应,平衡正向移动,能使PCl5分解率增大,所以b选项正确;温度、体积不变,充入氯气,平衡逆向移动,PCl5分解率减小,c选项错误;温度不变,增大容器体积,平衡正向移动,能使PCl5分解率增大,d选项正确;所以达到平衡后,使PCl5分解率增大的选项是bd;
PCl3(g)+Cl2(g)△H>0达到平衡后,温度、体积不变,充入氩气,反应物、生成物的浓度都没有改变,平衡不移动,a不能使PCl5分解率增大,a选项错误;体积不变,对体系加热,相当于升高温度,该反应的正反应是吸热反应,平衡正向移动,能使PCl5分解率增大,所以b选项正确;温度、体积不变,充入氯气,平衡逆向移动,PCl5分解率减小,c选项错误;温度不变,增大容器体积,平衡正向移动,能使PCl5分解率增大,d选项正确;所以达到平衡后,使PCl5分解率增大的选项是bd;
(4)①氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水,在废水中先加入适量漂白粉,使废水中的H3PO3氧化为PO43-,加入生石灰后能完全转化为磷酸的钙盐,达到较高的回收率;
②根据题干中的图可确定pH≥10,磷的沉淀回收率较高(90%左右),反应时间超过30 min时磷的沉淀回收率较高((90%左右),所以处理该厂废水最合适的工艺条件为溶液pH>10,反应时间>30min。