��Ŀ����
����Ŀ���⻯����ҽ�Ƽ�ʳƷ��������Ҫ�����á�ʵ������NaOH�����ʵ��ˮ����(N2H4��H2O)Ϊԭ���Ʊ��⻯�ơ���֪��ˮ���¾��л�ԭ�ԡ��ش��������⣺
(1)ˮ���µ��Ʊ���Ӧԭ��Ϊ��CO(NH2)2(����)+NaClO+2NaOH= N2H4��H2O +NaCl+Na2CO3
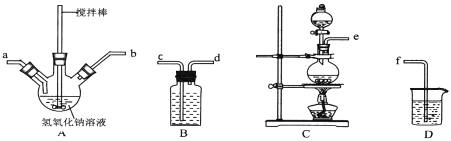
����ȡ�������ƺ��������ƻ��Һ������˳��Ϊ__________(������������Сд��ĸ��ʾ)������ʵ���¶ȿ��Ʋ�������Ӧ��������ƿ��ClO-��ClO3-�����ʵ���֮��Ϊ5��1�����������������Ʒ�Ӧʱ������ԭ����Ԫ���뱻��������Ԫ�ص����ʵ���֮��Ϊ____��
���Ʊ�ˮ����ʱ��Ӧ��__________�ε�__________�У�����NaClO��Һ������������Һ�������ҵμ��ٶȲ��ܹ��졣
�����صĵ���ʽΪ__________________
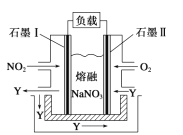
(2)�⻯�Ƶ��Ʊ�������ˮ���»�ԭ����ȡ�⻯�ƹ��壬���Ʊ�������ͼ��ʾ��
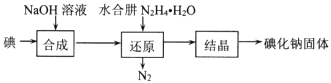
������ԭ�������У���Ҫ���ķ�Ӧ���������ɵĸ�����IO3-���ù��̵����ӷ���ʽΪ ___��
(3)�ⶨ��Ʒ��NaI������ʵ�鲽�����£�
a����ȡ10.00 g��Ʒ���ܽ⣬��500 mL����ƿ�ж��ݣ�
b����ȡ25.00 mL����Һ����ƿ�У�Ȼ�����������FeCl3��Һ����ַ�Ӧ���ټ���M��Һ��ָʾ����
c. ��0.2000 mol��L1�� Na2S2O3�� �� Һ �� �� �� �� ��(�� Ӧ �� �� ʽ2Na2S2O3+I2=Na2S4O6+2NaI)���ظ�ʵ���Σ�������ı���Һ�����Ϊ15.00 mL��
��MΪ____________(д����)��
�ڸ���Ʒ��NaI����������Ϊ_______________��
���𰸡�ecdabf 5��3 NaClO��Һ ������Һ  2IO3-+3N2H4��H2O=3N2��+2I-+9H2O ���� 90%
2IO3-+3N2H4��H2O=3N2��+2I-+9H2O ���� 90%
��������
(1)�ٸ����Ʊ����������ӣ��Ʊ��������ƺ��������ƣ�����β������������ƿ��ClO-��ClO3-�����ʵ���֮��Ϊ5��1����ClO-��ClO3-�����ʵ����ֱ�Ϊ5 mol��1 mol�����ݵ�ʧ�����غ㣬����5 molClO- �������Cl-5 mol������1 molClO3-�������Cl-5 mol���ݴ˷����ɵã�
��NaClO����ˮ���£�
��������Cԭ����Oԭ���γɹ���˫������2��-NH2��Nԭ���γɹ��۵�����
(2)���NaOH��Ӧ����NaI��NaIO��������IO3-������ˮ���»�ԭNaIO��������IO3-���õ������Ӻ͵������ᾧ�õ��⻯�ƣ��������̿�֪��������IO3-��ˮ�������ɵ����Ӻ͵������ݴ���д��
(3)�ٵⵥ�ʲ��룬�õ�����Һ��ָʾ����
�ڸ��ݵ�Ԫ���غ㣬2I-��I2��2Na2S2O3����n(NaI)=n(Na2S2O3)��������Ʒ��NaI���������������䴿�ȡ�
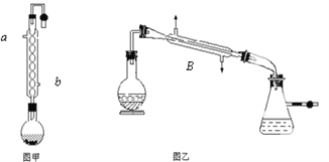
(1)��װ��C�ö������̺�Ũ�����ϼ����Ʊ���������Bװ�õı���ʳ��ˮ��ȥ����HCl���壬Ϊ��֤���ӳ�֣������ܳ����̳���������NaOH��A�з�Ӧ�Ʊ��������ƣ�Ϊʹ��Ӧ���ַ�Ӧ��Ҫʹ������a��ȥ����Dװ������δ��Ӧ���������Է�ֹ��Ⱦ�������ʵ���������˳��Ϊ��ecdabf������ƿ��ClO-��ClO3-�����ʵ���֮��Ϊ5��1����ClO-��ClO3-�����ʵ���֮��Ϊ5��1�����ʵ����ֱ�Ϊ5 mol��1 mol�����ݵ�ʧ�����غ㣬����6 molClO-�������Cl-�����ʵ���Ϊ5 mol������1mol ClO3-�������Cl- 5 mol����ԭ����Ԫ��Ϊ���ϼ۽��͵���Ԫ�أ���ΪCl-��n(Cl-)=5 mol+5 mol=10mol������������Ԫ��Ϊ���ϼ����ߵ���Ԫ�أ������ʵ���ΪClO-��ClO3-���ʵ����ĺͣ���5 mol+1 mol=6mol���ʱ���ԭ����Ԫ���뱻��������Ԫ�ص����ʵ���֮��Ϊ10��6=5��3��
���Ʊ�ˮ����ʱ�������صε�NaClO��Һ�л����μӣ�����ʹ������NaClO��Һ����ˮ���£����Ͳ��ʣ���ʵ�����Ʊ�ˮ���µIJ����ǣ�ȡ����A�еĻ��Һ��μ��뵽������������Һ���Ʊ�ˮ���£��μ�˳���ܵߵ����ҵμ��ٶȲ��ܹ��죻
������CO(NH2)2��Cԭ����Oԭ���γɹ���˫������2����NH2��Nԭ���γɹ��۵��������������ʽΪ��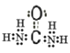 ��
��
(2)�������̿�֪��������IO3-��ˮ�������ɵ����Ӻ͵�������Ӧ�����ӷ���ʽΪ��2IO3-+3N2H4H2O=3N2��+2I-+9H2O��
(3)��ʵ���еζ��ⵥ�ʣ�Ӧ���õ�����ָʾ��������M�ǵ��ۣ�
�ڸ��ݵ�Ԫ���غ㣬2I-��I2��2Na2S2O3����n(NaI)=n(Na2S2O3)������Ʒ��NaI������m(NaI)=![]() ��150 g/mol=9.00 g������Ʒ��NaI����������Ϊ
��150 g/mol=9.00 g������Ʒ��NaI����������Ϊ![]() ��100%=90.0%��
��100%=90.0%��

����Ŀ����������ʵ���ó�����Ӧ������ȷ����
ʵ����ʵ | ���� | |
A | ����ͬ�¶��£���1 mL0.2 mol/LNaOH��Һ�е���2��0.1 mol/LMgCl2��Һ��������ɫ�������ٵμ�2��0.1 mol/LFeCl3��Һ�������ɺ��ɫ���� | �ܽ�ȣ�Mg(OH)2>Fe(OH)3 |
B | ij������ʹʪ�����ɫʯ����ֽ��� | ������ˮ��Һһ���Լ��� |
C | ͬ��ͬѹ�£������pH=3��HA��HB������ֱ���������п��Ӧ����ˮ���ռ����壬HA�ų����������ҷ�Ӧ���ʿ� | HB�����Ա�HAǿ |
D | SiO2����������ᷴӦ������Ӧ | SiO2������������ |
A.AB.BC.CD.D