题目内容
【题目】I.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+205.9 kJ/mol ①
CO(g)+3H2(g) △H1=+205.9 kJ/mol ①
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2 kJ/mol ②
CO2(g)+H2(g) △H2=-41.2 kJ/mol ②
二氧化碳重整:CH4(g)+CO2(g)![]() CO(g)+2H2(g) △H3 ③
CO(g)+2H2(g) △H3 ③
则反应①自发进行的条件是______________ ΔH3=________ kJ/mol。
Ⅱ.氮的化合物以及氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(2)在不同温度、压强和相同催化剂条件下,初始N2、H2分别为0.1 mol、0.3 mol时,平衡后混合物中氨的体积分数(φ)如图所示。
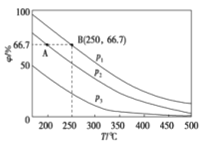
①其中,p1、p2和p3由大到小的顺序是____________,该反应ΔH_______0(填“>”“<”或“=”)。
②若分别用 vA(N2)和 vB(N2)表示从反应开始至达平衡状态 A、B 时的化学反应速率,则vA(N2)________vB(N2)(填“>”“<”或“=”)。
③若在250℃、p1为10 5Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2的分压p(N2)为_______Pa (分压=总压×物质的量分数,保留一位小数)。
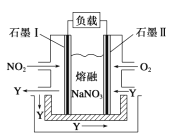
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如下图所示,石墨Ⅱ的电极名称为 _______。在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,石墨Ⅰ电极反应可表示为______________________。
【答案】高温 +247.1 p1>p2>p3 < < 8.3×103 正极 NO2-e-+NO3-=N2O5
【解析】
Ⅰ.(1)根据反应①的△H和△S分析自发性的条件,根据已知焓变的热化学方程式,结合盖斯定律计算所求反应的焓变;
Ⅱ.(2)①发生反应为N2+3H2![]() 2NH3,随着反应进行,气体分子数减少,体系压强减少,根据图象分析;
2NH3,随着反应进行,气体分子数减少,体系压强减少,根据图象分析;
②温度升高,化学反应速率增大;
③根据方程式计算B点N2的分压p(N2),分压=总压×物质的量分数;
(3)在燃料电池中,通入燃料的电极为负极,失去电子,发生氧化反应,通入氧气的电极为正极,得到电子发生还原反应,结合电解质及产生的物质书写电极反应式。
I.(1)反应①方程式CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+205.9 kJ/mol,可知该反应的正反应△H>0,△S>0,满足△H-T△S<0,因此反应自发进行的条件是高温;
CO(g)+3H2(g) △H1=+205.9 kJ/mol,可知该反应的正反应△H>0,△S>0,满足△H-T△S<0,因此反应自发进行的条件是高温;
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+205.9 kJ/mol,
CO(g)+3H2(g) △H1=+205.9 kJ/mol,
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2 kJ/mol,
CO2(g)+H2(g) △H2=-41.2 kJ/mol,
根据盖斯定律计算,①-②得到反应③的热化学方程式为:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)△H3=△H1-△H2=+247.1 kJ/mol;
2CO(g)+2H2(g)△H3=△H1-△H2=+247.1 kJ/mol;
II.(2)①由N2+3H2![]() 2NH3可知,在温度不变时,增大压强,化学平衡正向移动,NH3的含量增大。由图象可知在相同温度下,平衡后混合物中氨的体积分数(φ)为p1>p2>p3,因此压强关系是p1>p2>p3;
2NH3可知,在温度不变时,增大压强,化学平衡正向移动,NH3的含量增大。由图象可知在相同温度下,平衡后混合物中氨的体积分数(φ)为p1>p2>p3,因此压强关系是p1>p2>p3;
在压强相同时,升高温度,NH3的含量降低,说明升高温度,化学平衡向逆反应方向移动,根据平衡移动原理,升高温度,化学平衡向吸热反应分析移动,逆反应为吸热反应,则该反应的正反应为放热反应,故反应热小于零,该反应ΔH<0;
②温度越高,压强越大,反应速率越大,由于p1>p2,由图可知,B对应的温度高、压强大,所以反应速率B>A,即vA(N2)<vB(N2);
③设转化的氮气的物质的量为x,发生的反应为:N2+3H2![]() 2NH3,由于反应开始时n(N2)=0.1 mol,n(H2)=0.3 mol,根据物质反应转化关系可知:平衡时各种气体的物质的量分别为n(N2)=(0.1-x) mol,n(H2)=(0.3-3x) mol,n(NH3)=2x mol,在相同外界条件下气体的体积比等于气体的物质的量的比,所以
2NH3,由于反应开始时n(N2)=0.1 mol,n(H2)=0.3 mol,根据物质反应转化关系可知:平衡时各种气体的物质的量分别为n(N2)=(0.1-x) mol,n(H2)=(0.3-3x) mol,n(NH3)=2x mol,在相同外界条件下气体的体积比等于气体的物质的量的比,所以![]() =0.667,解得x=0.08,若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2的分压p(N2)=
=0.667,解得x=0.08,若在250℃、p1为105Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2的分压p(N2)=![]() Pa=8.3×103Pa;
Pa=8.3×103Pa;
(3)根据图示可知:在石墨电极II一侧通入O2,为原电池的正极;在石墨电极I一侧通入燃料,为原电池的负极,NO2失去电子变为NO3-,负极的电极反应式为:NO2-e-+NO3-=N2O5。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】乙烯是重要的有机化工原料,可由乙醇脱水制备。涉及反应如下:
①2CH3OH(g)![]() CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
CH3OCH3(g)+ H2O(g) △H1=—23.9 kJmol-1
②2CH3OH(g)![]() C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
C2H4(g)+2H2O(g) △H2= —29.1kJmol-1
③CH3CH2OH(g)![]() CH3OCH3(g) △H3= +50.7kJmol-1
CH3OCH3(g) △H3= +50.7kJmol-1
④C2H5OH(g)![]() C2H4(g)+ H2O(g) △H4=akJmol-1
C2H4(g)+ H2O(g) △H4=akJmol-1
回答下列问题:
(1)a=___________。
(2)在1.0L密闭容器中放入0.10 mol C2H5OH(g),在一定温度下进行④反应,反应时间(t)与容器内气体总压强(P)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强P/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
①欲提高C2H5OH的平衡转化率,应采取的措施为___________(填字母)。
a.升高温度 b.增大压强
c.通入乙醇 d.降低压强
②由总压强P和起始压强P0计算反应物C2H5OH的转化率(C2H5OH)的表达式为_________,平衡时C2H5OH的转化率为_______(结果保留两位有效数字,下同),该反应的平衡常数K=_________。
③用总压强P和起始压强P0表示反应体系的总物质的量n(总)和反应物C2H5OH的物 质的量n(C2H5OH),n(总)=_____mol,n(C2H5OH)=_____mol。
(3)下表为反应④中反应物浓度与反应时间的数据,分析该反应中c(C2H5OH)变化与时间间隔(△t)的规律,得出的结论是______,由此规律推出反应在12h时c(C2H5OH)等于______molL-1
反应时间t/h | 0 | 4 | 8 | 16 |
c(C2H5OH)/(molL-1) | 0.10 | 0.051 | 0.026 | 0.0065 |