题目内容
(6分)现有如下两个反应:
A.NaOH + HCl =" NaCl" + H2O B.2FeCl3+Cu =2FeCl2+CuCl2
(1)根据两反应本质, 判断能设计成原电池的是:_______,(填序号 )。
(2)不能的, 说明其原因_______________________________________________;(2分)
(3)如果可以, 写出负极材料及其电极反应式, 电解质溶液名称:
负极材料________,电极反应式_______________,电解质溶液名称____________,
(6分)⑴ B
⑵(A)的反应为非氧化还原反应, 没有电子转移
⑶ 铜, Cu-2e- =Cu2+, 氯化铁溶液 +(每空1分)
解析试题分析:(1)原电池中的化学反应是氧化还原反应,所以只有B是氧化还原反应,可设计成原电池;
(2)A反应是非氧化还原反应,没有电子的转移,不能构成原电池;
(3)B中发生氧化反应的是Cu,所以Cu作负极,正极材料是比Cu不活泼的金属或石墨即可;电极反应式是Cu-2e- =Cu2+,溶液中的铁离子发生还原反应生成亚铁离子,所以电解质溶液是氯化铁溶液。
考点:考查原电池的构成条件,电极反应式、电极材料、电解质溶液的判断

练习册系列答案
相关题目
由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。下图是氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是( )
| A.a处通人氧气,b处通人氢气 |
| B.该装置中只涉及两种形式的能量转化 |
| C.电池正极电极反应式为O2+2H2O+4e-﹦4OH- |
| D.P一型半导体连接的是电池负极 |
下列关于下图所示原电池装置的叙述正确的是( )
| A.铜片是负极 | B.铜片质量逐渐减少 |
| C.氢离子在铜片表面被还原 | D.电流从锌片经导线流向铜片 |


 、
、 和
和 离子,加入下列沉淀剂的顺序是(填序号)_____________ 。
离子,加入下列沉淀剂的顺序是(填序号)_____________ 。 B.
B. 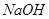 C.
C. 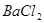
 调至酸性除去的离子有___________________。
调至酸性除去的离子有___________________。 溶液的离子方程式是_____________________。
溶液的离子方程式是_____________________。
 晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 _____________________ 。
晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是 _____________________ 。

