题目内容
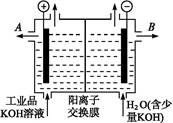
(8分)将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:
(以下均假设反应过程中溶液体积不变)。
⑴铁片上的电极反应式为 。
⑵铜片周围溶液会出现 的现象。
⑶若2 min后测得铁片和铜片之间的质量差为1.2g,计算:
①导线中流过的电子的物质的量为 mo1;
②该段时间内用硫酸铜表示的平均反应速率为
(1)Fe-2e-=Fe 2+;(2)溶液颜色变浅;(3)①0.02;② 0.01mol?L-1?min-1。
解析试题分析:(1)铁片、铜片和硫酸铜溶液构成原电池,铁较活泼,作原电池的负极,电极反应式为Fe-2e-=Fe 2+;(2)铜电极作原电池的正极,电极反应式为Cu2++2e-=Cu,铜离子浓度降低,则溶液颜色变浅;(3)①负极上铁溶解,正极上析出铜,铁片和铜片相差的质量为溶解铁和析出铜的质量之和,溶解铁的物质的量和析出铜的物质的量相等,设转移电子的物质的量为xmol,x/2×56+x/2×64=1.2,x=0.02;②硫酸铜的平均反应速率=0.01mol/(2min×0.5L)=0.01mol?L-1?min-1。
考点:考查原电池原理。

练习册系列答案
相关题目
两种金属A与B和稀硫酸组成原电池时,A是正极。下列有关推断正确的是
| A.A的金属性强于B | B.电子不断由A电极经外电路流向B电极 |
| C.A电极上发生的电极反应是还原反应 | D.A的金属活动性一定排在氢前面 |
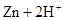 ══
══ ↑的反应设计原电池。
↑的反应设计原电池。
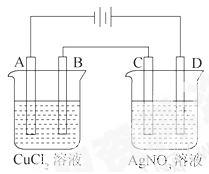


 LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。 FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe—
FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe— XLi++6C,写出电池放电时的电极反应的化学方程式 。
XLi++6C,写出电池放电时的电极反应的化学方程式 。