题目内容
【题目】Ⅰ.氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i. CH3OH(g) ![]() CO(g)+ 2H2(g) △H =+90kJ·mol-1
CO(g)+ 2H2(g) △H =+90kJ·mol-1
ii. CO(g)+H2O(g)![]() CO2(g)+ H2(g) △H =-41kJ·mol-1
CO2(g)+ H2(g) △H =-41kJ·mol-1
(1)向VL 恒容密闭容器中充入lmol CH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T) 变化关系的曲线为_______________(填“A”或“B”)。T1℃时,体系的平衡压强与起始压强之比为_________________________。

(2)起始向10L 恒容密闭容器中充入lmol CH3OH(g)和1molH2O(g),发生反应i和反应ii,体系中CO的平衡体积分数与温度(T)和压强(P)的关系如图2所示。
①P1、P2、P3由大到小的顺序为___________________。
②测得C点时、体系中CO2的物质的量为0.2mol,则T2℃时,反应ii 的平衡常数K=________。
Ⅱ.现有HA、HB 和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。
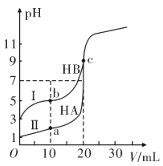
(1)a点时的溶液中由水电离出的c(H+)=________mol·L-1。
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为_____________________________;
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
① 若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C 的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
【答案】 B 9:5 P1>P2>P3 0.875 3×10-13 c(Na+)>c(B-)>c(OH-)>c(H+) NaHC=Na++H++C2- > >
【解析】Ⅰ. (1) CH3OH(g) ![]() CO(g)+2H2(g)△H =+90kJ·mol-1,升高温度,平衡正向移动,CHOH(g)的平衡转化率(a)增大,满足条件的是曲线B;T1℃时,CHOH(g)的平衡转化率为40%,则平衡时,CH3OH、CO、H2的物质的量分别为0.6mol、0.4mol、0.8mol,平衡压强与起始压强之比等于物质的量之比=
CO(g)+2H2(g)△H =+90kJ·mol-1,升高温度,平衡正向移动,CHOH(g)的平衡转化率(a)增大,满足条件的是曲线B;T1℃时,CHOH(g)的平衡转化率为40%,则平衡时,CH3OH、CO、H2的物质的量分别为0.6mol、0.4mol、0.8mol,平衡压强与起始压强之比等于物质的量之比=![]() =
=![]() ,故答案为:B;
,故答案为:B;![]() ;
;
(2)①ii. CO(g)+H2O(g)![]() CO2(g)+H2(g)改变压强,平衡不移动,i. CH3OH(g)
CO2(g)+H2(g)改变压强,平衡不移动,i. CH3OH(g) ![]() CO(g)+2H2,增大压强,平衡逆向移动,CO的平衡体积分数减小,因此P1、P2、P3由大到小的顺序为P1>P2>P3,故答案为:P1>P2>P3;
CO(g)+2H2,增大压强,平衡逆向移动,CO的平衡体积分数减小,因此P1、P2、P3由大到小的顺序为P1>P2>P3,故答案为:P1>P2>P3;
②i. CH3OH(g) ![]() CO(g)+2H2(g)
CO(g)+2H2(g)
起始(mol) 1 0 0
反应(mol) x x 2x
平衡(mol)1-x x 2x
ii. CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始(mol) x 1 0 2x
反应(mol)0.2 0.2 0.2 0.4
平衡(mol)x-0.2 0.8 0.2 2x+0.4
根据体系中CO的平衡体积分数为12.5%,有![]() =
=![]() ,解得x=0.6,则反应ii的平衡常数K=
,解得x=0.6,则反应ii的平衡常数K=![]() =0.875,故答案为:0.875;
=0.875,故答案为:0.875;
Ⅱ. (1)根据图像,0.1mol·L-1的HA的pH=1,说明HA为强酸,完全电离,a点时的溶液中含有等物质的量浓度的HA和NaA,溶液的体积为30mL,此时c(H+)=![]() =
=![]() mol/L,则c(OH-)=
mol/L,则c(OH-)=![]() =
=![]() =3×10-13 mol/L,故答案为:3×10-13;
=3×10-13 mol/L,故答案为:3×10-13;
(2)根据图像,0.1mol·L-1的HB的pH=3,说明HB为弱酸,c点恰好生成NaB,水解,溶液显碱性,溶液中各离子浓度由大到小的顺序为c(Na+)>c(B-)>c(OH-)>c(H+),故答案为:c(Na+)>c(B-)>c(OH-)>c(H+);
(3)①常温下向0.1mol·L-1的NaHC溶液中滴入几滴石蕊试液后溶液变成红色,溶液呈酸性,若测得此溶液的pH=1,说明NaHC完全电离,电离方程式为NaHC=Na++H++C2-,故答案为:NaHC=Na++H++C2-;
②常温下向0.1mol·L-1的NaHC溶液中滴入几滴石蕊试液后溶液变成红色,溶液呈酸性,若在此溶液中能检测到H2C分子,说明NaHC的电离程度大于水解程度,则此溶液中c(C2-)>c(H2C) ,故答案为:>;
③若H2C的一级电离为H2C=H++HC-,常温下0.1mol·L-1H2C溶液中的c(H+)=0.11mol·L-1,H2C的一级电离产生的氢离子会抑制HC-的电离,抑制后HC-电离的c(H+)=0.01mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)>0.01mol·L-1,故答案为:>。