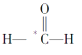题目内容
【题目】A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为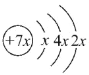 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)A为____(写出元素符号,下同);
(2)B为____,简化电子排布式是____;
(3)C为____,核外电子排布式是____;
(4)D为____,轨道表示式是____;
(5)E原子结构示意图是____。
【答案】Si Na [Ne]3s1 P 1s22s22p63s23p3 N ![]() 。
。 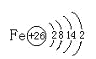
【解析】
A、B、C、D是四种短周期元素,由A的原子结构示意图可知,x=2,A的原子序数为14,故A为Si元素;A、B、C同周期,B是同周期除稀有气体外半径最大的元素,故B为Na元素,C的最外层有三个成单电子,C原子的3p能级有3个电子,故C为P元素;C、D同主族,故D为N元素;E是过渡元素,E的外围电子排布式为3d64s2,则E为Fe元素,据此答题。
(1)由上述分析可知,A为硅元素,元素符号为Si,故答案为:Si;
(2)由上述分析可知,B为Na元素,原子核外电子数为11,简化电子排布式是:[Ne]3s1,
故答案为:Na;[Ne]3s1;
(3)由上述分析可知,C为P元素,最外层电子数为5,核外电子排布式为:1s22s22p63s23p3,故答案为:P;1s22s22p63s23p3;
(4)由上述分析可知,D为N元素,原子核外电子数为7,其轨道表示式为:![]() ,故答案为:N;
,故答案为:N;![]() ;
;
(5)由上述分析可知,E为Fe元素,是26号元素,Fe原子结构示意图是: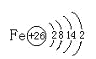 ,故答案为:
,故答案为: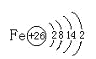 。
。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案【题目】(1)已知在常温常压下:
①CH3OH(l)+ O2(g)=CO(g)+ 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________________________ 。
(2)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
CH3OH(g)+H2O(g) △H=-49.0kJ/mol。相关数据如下:
容器 | 甲 |
反应物投入量 | 1mol CO2(g)和3mol H2(g) |
平衡时c(CH3OH) | c1 |
平衡时能量变化 | 放出29.4kJ |
若甲中反应10s时达到平衡,则用CO2来表示甲中反应从开始到平衡过程中的平均反应速率是_____mol/(L·s)。
(3)铅蓄电池放电时总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。铅蓄电池放电时的正极反应式为____ ,当电路中有0.2mol电子转移时,理论上两电极质量变化的差为_______ g。
(4)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
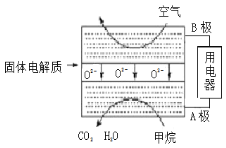
①A极电极反应式为____________________。
②若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中O2体积为20%),则理论上消耗甲烷________mol。