题目内容
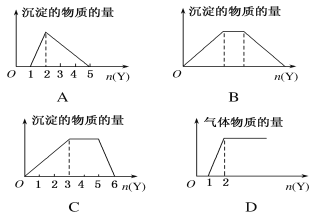
【题目】如图所示,纵轴表示导电能力,横轴表示所加溶液的量,下列说法正确的是( )
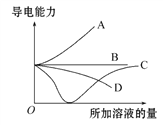
A. 曲线A表示NaOH溶液中滴加稀盐酸
B. 曲线B表示CH3COOH溶液中滴加KOH溶液
C. 曲线C表示Ba(OH)2溶液中滴加稀硫酸
D. 曲线D表示Cu(OH)2悬浊液中滴加HNO3溶液
【答案】C
【解析】A、NaOH溶液中滴加稀盐酸,导电能力基本保持不变,应该是曲线B,选项A错误;B、CH3COOH溶液中滴加KOH溶液,开始滴加时导电能力增强,应该是曲线A,选项B错误;C、Ba(OH)2溶液中滴加稀硫酸,反应生成硫酸钡沉淀和极弱电解质水,离子浓度降低,当硫酸过量时离子浓度增大,导电能力先减小再增大,应该是曲线C,选项C正确;D、Cu(OH)2悬浊液中滴加HNO3溶液,沉淀溶解,离子浓度增大,开始滴加时导电能力增强,应该是曲线A,选项D错误。答案选C。

练习册系列答案
相关题目