题目内容
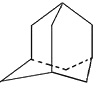
【题目】近年来有多个关于超高压下新型晶体的形成与结构的研究报道。NaCl晶体在50~300GPa的高压下和Na或Cl2反应,可以形成不同组成、不同结构的晶体。如图给出其中三种晶体的晶胞(大球为氯原子,小球为钠原子),关于这三种晶胞的说法正确的是( )
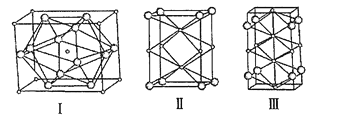
A.晶胞Ⅰ中钠原子的配位数为12
B.晶胞Ⅱ中含有6个钠原子
C.晶胞Ⅲ所对应晶体的化学式为Na2Cl
D.三种晶体均是由NaCl晶体在50~300GPa的高压下和Na反应所得
【答案】AC
【解析】
根据原子分摊可知,晶胞I中:晶胞中Na原子数目=1+8×![]() =2、Cl原子数目=12×
=2、Cl原子数目=12×![]() =6,化学式为NaCl3;晶胞II中Na原子数目=2+4×
=6,化学式为NaCl3;晶胞II中Na原子数目=2+4×![]() =3、Cl原子数目=8×
=3、Cl原子数目=8×![]() =1,化学式为Na3Cl;晶胞III中Na原子数目=2+4×
=1,化学式为Na3Cl;晶胞III中Na原子数目=2+4×![]() +2×
+2×![]() =4、Cl原子数目=8×
=4、Cl原子数目=8×![]() =2,化学式为Na2Cl,根据反应条件(NaCl晶体在50~300GPa的高压下和Na或Cl2反应,可以形成不同组成、不同结构的晶体)和原子守恒可知,晶胞I所对应晶体是NaCl晶体在50~300GPa的高压下和Cl2反应的产物,晶胞II、III所对应晶体是NaCl晶体在50~300GPa的高压下和Na反应的产物,据此分析解答。
=2,化学式为Na2Cl,根据反应条件(NaCl晶体在50~300GPa的高压下和Na或Cl2反应,可以形成不同组成、不同结构的晶体)和原子守恒可知,晶胞I所对应晶体是NaCl晶体在50~300GPa的高压下和Cl2反应的产物,晶胞II、III所对应晶体是NaCl晶体在50~300GPa的高压下和Na反应的产物,据此分析解答。
A.由图可知,晶胞中12个Cl原子位于面上,所以体心Na原子周围有12个Cl,即钠原子的配位数为12,故A正确;
B.Na有2个位于体内,4个位于棱心,棱心被4个晶胞共用,钠原子个数为2+4×![]() =3,即晶胞Ⅱ中含有3个钠原子,故B错误;
=3,即晶胞Ⅱ中含有3个钠原子,故B错误;
C.晶胞III中Na原子数目=2+4×![]() +2×
+2×![]() =4、Cl原子数目=8×
=4、Cl原子数目=8×![]() =2,化学式为Na2Cl,故C正确;
=2,化学式为Na2Cl,故C正确;
D.晶胞I、II、Ⅲ所对应晶体的化学式分别为NaCl3、Na3Cl、Na2Cl,根据原子守恒可知,晶胞I所对应晶体是NaCl晶体在50~300GPa的高压下和Cl2反应的产物,晶胞II、III所对应晶体是NaCl晶体在50~300GPa的高压下和Na反应的产物,故D错误;
答案选AC。

 阅读快车系列答案
阅读快车系列答案【题目】肼是一种高能燃料。已知各共价键键能(断裂或形成1mol共价键时吸收或释放的能量)如表:
N≡N | O=O | N-N | N-H | O-H | |
键能(KJmol﹣1) | 946 | 497 | 154 | 391 | 463 |
(1)N2H4(g)+O2(g)N2(g)+2H2O(l) H=________KJmol﹣1 。
(2)密闭容器中进行反应:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g) H<0反应的化学平衡表达式为K=________。
Fe3O4(s)+4H2(g) H<0反应的化学平衡表达式为K=________。
(3)已知:600℃时,上述反应的平衡常数K=16。现有如图甲(恒温恒压)和如图乙(恒温恒容)两容器:
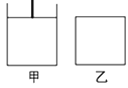
起始时按下表所示分别加入各物质,体积为2L,在600℃时反应经过一段时间后均达平衡。
Fe | H2O(g) | Fe3O4 | H2 | |
甲/mol | 2.0 | 1.0 | 2.0 | 0.5 |
乙/mol | 2.0 | 2.0 | 2.0 | 1.0 |
①关于甲、乙容器,下列法正确的是________。
A.反应开始时两容器内的逆反应速率:甲<乙
B.若甲容器内气体的密度不再变化,则说明反应已达到平衡状态
C.若乙容器内气体的压强不再变化,则说明反应已达到平衡状态
D.平衡后添加Fe3O4,两容器内的平衡均逆向移动
②投料后甲5min达平衡,则此段时间内的平均反应速率v(H2)=________。
③平衡后若将乙容器体系温度突然降低100℃,图象中能正确反映平衡移动过程中容器内变化情况的是________。
A. 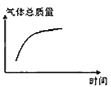 B.
B. 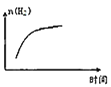 C.
C. 
(4)如图为恒容绝热容器:

进行上述反应,起始与平衡时的各物质的量见表:
Fe | H2O(g) | Fe3O4 | H2 | |
起始/mol | 3.0 | 3.0 | 0 | 0 |
平衡/mol | m | n | p | q |
Fe | H2O(g) | Fe3O4 | H2 | |
A/mol | 3.0 | 3.0 | 0 | 0 |
B/mol | 0 | 0 | 3.0 | 3.0 |
C/mol | m | n | p | q |
若在达到平衡后的容器丙中,分别按照下列A、B、C三种情况继续添加各物质,则再次达平衡时,容器丙中H2的百分含量按由大到小的顺序______(用A、B、C表示)。