��Ŀ����
����Ŀ������һ�ָ���ȼ�ϡ���֪�����ۼ�����(���ѻ��γ�1mol���ۼ�ʱ���ջ��ͷŵ�����)�����
N��N | O=O | N-N | N-H | O-H | |
����(KJmol��1) | 946 | 497 | 154 | 391 | 463 |
(1)N2H4(g)+O2(g)N2(g)+2H2O(l) H=________KJmol��1 ��
(2)�ܱ������н��з�Ӧ��3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g) H��0��Ӧ�Ļ�ѧƽ�����ʽΪK=________��
Fe3O4(s)+4H2(g) H��0��Ӧ�Ļ�ѧƽ�����ʽΪK=________��
(3)��֪��600��ʱ��������Ӧ��ƽ�ⳣ��K=16��������ͼ��(���º�ѹ)����ͼ��(���º���)��������
��ʼʱ���±���ʾ�ֱ��������ʣ����Ϊ2L����600��ʱ��Ӧ����һ��ʱ������ƽ�⡣
Fe | H2O(g) | Fe3O4 | H2 | |
��/mol | 2.0 | 1.0 | 2.0 | 0.5 |
��/mol | 2.0 | 2.0 | 2.0 | 1.0 |
�ٹ��ڼס������������з���ȷ����________��
A.��Ӧ��ʼʱ�������ڵ��淴Ӧ���ʣ��ף���
B.����������������ܶȲ��ٱ仯����˵����Ӧ�Ѵﵽƽ��״̬
C.���������������ѹǿ���ٱ仯����˵����Ӧ�Ѵﵽƽ��״̬
D.ƽ�������Fe3O4���������ڵ�ƽ��������ƶ�
��Ͷ�Ϻ��5min��ƽ�⣬��˶�ʱ���ڵ�ƽ����Ӧ����v(H2)=________��
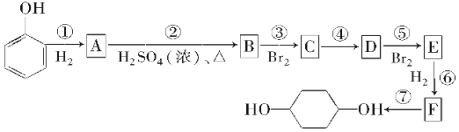
��ƽ���������������ϵ�¶�ͻȻ����100����ͼ��������ȷ��ӳƽ���ƶ������������ڱ仯�������________��
A.  B.
B.  C.
C. 
(4)��ͼΪ���ݾ���������

����������Ӧ����ʼ��ƽ��ʱ�ĸ����ʵ���������
Fe | H2O(g) | Fe3O4 | H2 | |
��ʼ/mol | 3.0 | 3.0 | 0 | 0 |
ƽ��/mol | m | n | p | q |
Fe | H2O(g) | Fe3O4 | H2 | |
A/mol | 3.0 | 3.0 | 0 | 0 |
B/mol | 0 | 0 | 3.0 | 3.0 |
C/mol | m | n | p | q |
���ڴﵽƽ�����������У��ֱ�������A��B��C��������������Ӹ����ʣ����ٴδ�ƽ��ʱ����������H2�İٷֺ������ɴ�С��˳��______(��A��B��C��ʾ)��
���𰸡�583 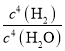 AB 0.05molL-1min1 B B>C>A
AB 0.05molL-1min1 B B>C>A
��������
��1������ͼ�����ݣ����Կ���N2H4(g)+O2(g)![]() N2(g)+2H2O��Ӧ���ʱ���ھɼ��������յ��������¼������ͷŵ�����֮�����H=(154+391��4+497946463��4)kJ/mol=583kJ/mol���ʴ�Ϊ��583��
N2(g)+2H2O��Ӧ���ʱ���ھɼ��������յ��������¼������ͷŵ�����֮�����H=(154+391��4+497946463��4)kJ/mol=583kJ/mol���ʴ�Ϊ��583��
��2����ѧƽ�����ʽΪK= ��
��
��3����A����Ӧ��ʼʱ��������H2��Ũ�Ƚϴ������淴Ӧ���ʣ���<�ң�����ȷ��
B��ˮ�������ܶ����������ܶȲ�ͬ�����Ե������ڵ��ܶȲ���ʱ������ƽ��״̬������ȷ��
C���÷�ӦΪ�����������ķ�Ӧ������������ѹǿʼ�ղ��䣬������ѹǿ�ж�ƽ��״̬���ʴ���
D��ƽ�������Fe3O4�����ӹ������ƽ�ⲻ�ƶ����ʴ���
��ѡAB��
��Ͷ�Ϻ��5min��ƽ�⣬��˶�ʱ���ڵ�ƽ����Ӧ����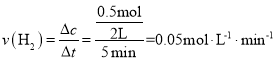 ���ʴ�Ϊ��0.05molL-1min1��
���ʴ�Ϊ��0.05molL-1min1��
�۷�Ӧ�Ƿ��ȷ�Ӧ������ƽ����ϵ�¶Ƚ���100����ƽ�������ƶ���
A�������ƶ�H2Oת��Ϊ�����ʵ�����H2������������С����A�����ϣ�
B��ƽ�������ƶ����������ʵ�������B���ϣ�
C����Ӧǰ���������������仯���ܶ��淴Ӧ���з����仯����C�����ϣ�
�ʴ�Ϊ��B��
��4�����ڷ�Ӧǰ�����������ȣ�����C�����£�ƽ�ⲻ�ƶ������������������ƽ������ͬ��A״���£���Ӧ�������������������Ӧ�ų�����ʹ�����¶����ߣ����Ʒ�Ӧ����������������������������ϵͣ�B״���·�Ӧ�����������Fe��ˮ�������ȹ��̣�ʹ�����¶Ƚ��ͣ����Ʒ�Ӧ��������������������������������ϸߣ���H2�İٷֺ������ɴ�С��˳�����У�B>C>A��
�ʴ�Ϊ��B>C>A��