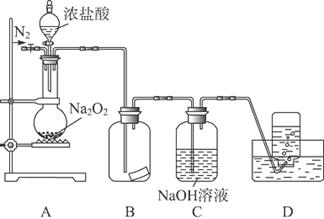
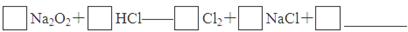题目内容
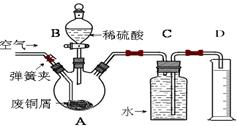
某课外兴趣小组为探究某种铝合金(合金元素为Mg Al)是否符合国家质量标准(国家规定其中铝含量不能低于78%),设计右图装置进行实验。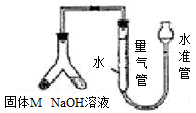
(1)如何检验该装置的气密性 。
(2)合金样品固体M与氢氧化钠溶液反应的离子方程式 。
(3)倾斜左边装置使氢氧化钠溶液(足量)与ag合金粉末(固体M)充分反应,待反应停止后,进入量气管气体的体积为VmL(已折算成标准状况)。若量气管最大量程为50mL,则固体M中铝的质量(m)范围为 。
(4)若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积 (填“>”“<”“=”)VmL。
(5)若a=38mg,V=44.8mL(标准状况),请通过计算说明该合金是否符合国家标准(不写计算过程) (填“符合”或“不符合”)。
(1)安装好装置并在量气管内加人水,向下移动水准管,静置片刻。若水准管中液面与量气管液面维持一定的高度差,说明装量密封(合理即给分)
(2)2Al+2OH-+2H2O=2AlO2-+3H2↑ (3)0<m<0.04g(或m<0.04g (4)> (5)符合
解析试题分析:(1)装置气密性的检验,原理通常是想办法造成装置不同部位气体有压强差,并产生某种明显的现象。所以根据该装置的特点可知,检验方法是安装好装置并在量气管内加人水,向下移动水准管,静置片刻。若水准管中液面与量气管液面维持一定的高度差,说明装量密封。
(2)镁与氢氧化钠溶液不反应,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。
(3)由于量气管最大量程为50mL,这说明反应中最多只能产生50ml氢气,标准状况下的物质的量= =
= mol。所以根据方程式2Al+2OH-+2H2O=2AlO2-+3H2↑可知最多消耗率的质量=
mol。所以根据方程式2Al+2OH-+2H2O=2AlO2-+3H2↑可知最多消耗率的质量= mol×
mol×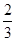 ×27g/mol=0.04g,因此固体M中铝的质量(m)范围为0<m<0.04g。
×27g/mol=0.04g,因此固体M中铝的质量(m)范围为0<m<0.04g。
(4)由于合金中镁能和盐酸反应放出氢气,所以若将装置中的氢氧化钠溶液替换为足量的盐酸,则反应停止后量气管内气体体积>VmL。
(5)V=44.8mL(标准状况),则氢气的物质的量=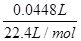 =0.002mol,所以消耗铝的质量=0.002mol×
=0.002mol,所以消耗铝的质量=0.002mol×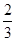 ×27g/mol=0.036g=36mg。则合金中铝的质量分数=
×27g/mol=0.036g=36mg。则合金中铝的质量分数=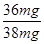 ×100%=94.74%>78%,所以符合国家标准。
×100%=94.74%>78%,所以符合国家标准。
考点:考查合金中元素含量测定的实验探究、设计、评价以及计算等

某研究性学习小组在网上收集到信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入盛满CO2的集气瓶中,钠在 其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘 附着白色物质。
(1)通过钠在CO2气体中燃烧的实验,你认为燃烧的条件是:
_________________________________________________________________。
(2)燃烧的本质是:_____________________________________________。
(3)2010年8月初发生的俄罗斯森林大火着火面积比伦敦市的面积还要大。控制森林火灾是世界性难题。根据燃烧的条件,请你解释为什么设置森林防火隔离带能有效阻止森林火灾的蔓延:_____________________________________________________________。
【提出假设】
假设1:白色物质是Na2O
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物
【设计实验方案·验证假设】该小组对燃烧后的白色产物进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
【思考与交流】
(4)甲同学认为方案1得到的结论不正确,其理由是:___________________________________
(5)乙同学认为方案2得到的结论正确,白色物质为:________。
(6)通过方案1和方案2的实验,你认为上述三个假设中,________成立。你的理由是:_____________________________________________________。
(7)钠在二氧化碳中燃烧的化学方程式为:____________________________
(8)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由:
________________________________________________________
铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
(1)试剂1是 ,加入新制氯水后溶液中发生的离子反应方程式是: , ;
(2)加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是 ;
(3)在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
| 编号 | 猜 想 |
| 甲 | 溶液中的+3价Fe又被还原为+2价Fe |
| 乙 | 溶液中的SCN-被过量的氯水氧化 |
| 丙 | 新制的氯水具有漂白性,将该溶液漂白 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | | |
| | | |
| | | |
硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白: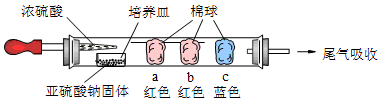
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | | 棉球变白,微热后又恢复红色 |  |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | | 棉球变为白色 | 结论:该气体具有 性 |
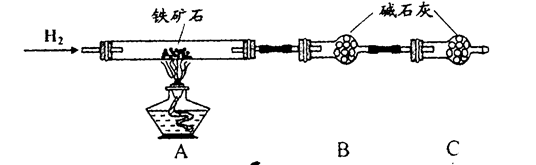
实验一:铁矿石中含氧量的测定
a.按上图组装仪器(夹持仪器均省略),检查装置的气密性;
b.将5.0g铁矿石放入硬质玻璃管中;
c.从左端导气管口处不断地缓缓通入H2, 后,点燃A处酒精灯;
d.充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)步骤c中填空
(2)测得反应后装置B增重1.35g,则铁矿石中氧的质量分数为______________________。实验二:铁矿石中含铁量的测定

(3)步骤④中煮沸的目的是_____________________________________________。
(4)步骤②和⑤中都要用到的玻璃仪器是______ __。
(5)下列有关步骤⑥的操作中说法不正确的是_______________________________。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶不需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成
(6)由实验一、二得出该铁矿石中铁的氧化物的化学式为____________________________。
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性。某兴趣小组用如图所示装置进行Mg与SO2反应的实验。
(1)选择制取SO2的合适试剂 (填编号)。
①浓HCl ②浓H2SO4 ③Na2SO3固体 ④CaSO3固体
(2)上述装置还可优化,优化的方法是 ,装置C中NaOH溶液的作用是 。
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
;乙同学的推测是:2Mg+3SO2 2MgSO3+S;丙同学的推测是:3Mg+SO2
2MgSO3+S;丙同学的推测是:3Mg+SO2 2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
2MgO+MgS,要验证甲、乙、丙三位同学的推测是否正确,丁同学作如下实验探究:
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀。
限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选。
| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后所得固体于试管中 | |
| ② | 向试管中的固体慢慢滴加 , 试管口塞上带导管的单孔塞,并将导管通入盛有 的试管中。 | 若试管中的 , 则丙同学推测正确。 若试管中的固体未完全溶解,且 ,则乙同学推测正确。 |
(4)上述实验需要100mL,2mol/L的HCl,配制时选用 (选填10 mL、25 mL、50 mL或100 mL)量筒量取36.5%,密度1.19g/mL的浓盐酸的体积为 mL。(保留三位有效数字)