题目内容
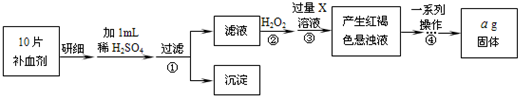
铁是人体不可缺少的微量元素,硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂(每片b克)中铁元素的含量。实验步骤如下: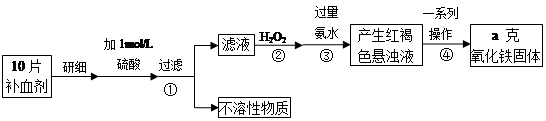
请回答下列问题:
(1)步骤②中H2O2的作用是使Fe2+完全被 (填“氧化”或“还原”)为 Fe3+.
(2)步骤③所得的红褐色悬浊液中除H2O2、氨水外主要还含 和 (填化学式).
(3)步骤④中一系列处理的操作步骤为 、洗涤、灼烧、冷却、称量.
(4)实验中用已经准确量取的浓硫酸配制100 mL 1 mol/L的硫酸溶液,则配制时用到的仪器除烧杯、玻璃棒,还有两种仪器是 .
(5)若实验无损耗,则每片补血剂含铁元素的质量分数为 .
(6)下列操作会导致所测定的铁元素含量偏高的是
A. 步骤③所加氨水量不足 B. 步骤④洗涤不充分 C. 步骤④灼烧不充分
(1)氧化 (2)(NH4)2SO4、Fe(OH)3 (3)过滤
(4)100 mL容量瓶、胶头滴管 (5)7a/b % (6)BC
解析试题分析:(1)双氧水具有强氧化性,由流程图可知,加入双氧水目的是将Fe2+全部氧化为Fe3+,故答案为:氧化; (2)根据反应图示,过量的硫酸能够与氨水反应生成硫酸铵;红褐色的物质是氢氧化铁,故答案为:(NH4)2SO4;Fe(OH)3; (3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量,故答案为:过滤;(4)精确配制100mL 1mol/L的硫酸溶液,配制时需要的仪器有天平、药匙、玻棒、烧杯、胶头滴管、100mL容量瓶,所以还需要100mL容量瓶、胶头滴管,故答案为:100mL容量瓶、胶头滴管; (5)10片补血剂中氧化铁的物质的量为:a/160mol,含有的铁元素质量为:2×a/160×56g=0.7ag,每片补血剂含铁元素的质量分数为:(1/10)×0.7a/b×100%=7a/b%.故答案为:7a/b%
(6)A、步骤③所加氨水量不足,铁离子沉淀不完全,生成的氢氧化铁减少,氧化铁质量减少,测定结果偏低,故A错误;B、步骤④洗涤不充分,会导致氧化铁的质量偏大,测得的铁元素质量分数偏大,故B正确;C、步骤④灼烧不充分,会导致氧化铁固体的质量偏大,铁元素质量分数偏大,故C正确;故选BC.
考点:本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力。

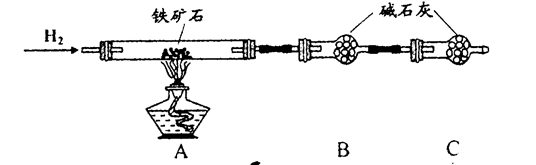
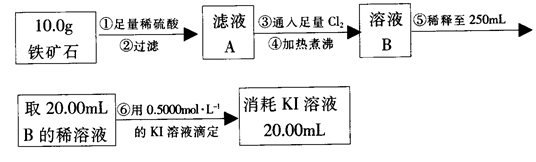
(16分)铁触媒(铁的某氧化物)是工业合成氨的催化剂。某同学设计了以下两种方案研究铁触媒的组成。
方案一:用下列流程测定铁触媒的含铁量,确定其组成。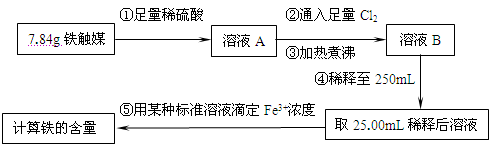
(1)步骤④后面需用 (填仪器名称)取25.00mL稀释后溶液。
(2)因为通入Cl2不足量,“溶液B”中还含有 会影响测定结果。
(3)因为通入Cl2过量且加热煮沸不充分,“溶液B”中可能含有Cl2。请设计实验方案检验Cl2,完成下列实验报告。
限选试剂:0.1mol·L-1酸性KMnO4溶液、紫色石蕊试液、品红稀溶液、淀粉-KI溶液、0.1moL·L-1KSCN溶液
| 实验操作 | 实验现象与结论 |
| | |
方案二:用下列实验方法测定铁触媒的含铁量,确定其组成。
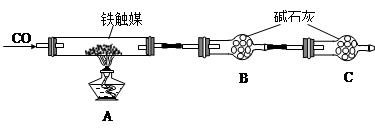
(4)“干燥管C”的作用是 。
(5)称取15.2g铁触媒进行上述实验。充分反应后,测得“干燥管B”增重11.0g,则该铁触媒的化学式可表示为 。(相对原子质量:C-12 O-16 Fe-56)
某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质R,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设A:该固体物质是FeCl3;
假设B:__________________________________________________________;
假设C:__________________________________________________________。
(2)设计实验方案:
取少量固体物质R于烧杯中,加适量水溶解,然后取两份R溶液分别进行实验,实验现象与结论如下表,请在表格内填写实验现象:
| 实验方法 | 实验现象 | 结论 |
| ①向R溶液中 加KSCN溶液 | | 固体物质中有FeCl3 |
| ②向R溶液中滴加 酸性KMnO4溶液 | | 固体物质中不含FeCl2 |
由此得出结论:假设________成立(填字母)。
(3)写出向R溶液中滴加少量KSCN溶液的离子方程式: 。25°C时,测得该反应达平衡时的平衡常数为K1,保持温度不变,继续滴加少量KSCN溶液,达新平衡时,测得平衡常数为K2,则K1 K2(填“>”,“<”或“=”),溶液的颜色 (填“变深”,“变浅”或“不变”)。
(4)R溶液常作印刷电路铜板的腐蚀剂,写出该反应的离子方程式:___________________________。
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校化学实验小组通过实验探究某红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4。
设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
(1)若只有Fe2O3,则实验现象是_____________。
(2)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则此过程中的离子反应为:
____________________________。
(3)经实验分析,确定红色粉末为Cu2O和Fe2O3的混合物。实验小组欲测定Cu2O的质量分数。已知Cu2O在空气中加热生成CuO。
测定流程: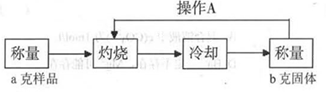
实验中操作A的名称为_____________。
灼烧过程中,所需仪器有:酒精灯、玻璃棒、_____________等(夹持仪器除外)。
(4)写出混合物中Cu2O的质量分数的表达式_____________。
实验小组欲利用红色粉末制取较纯净的胆矾(CuSO4?5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下: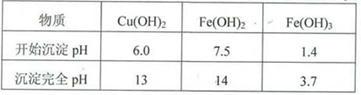
实验室有下列试剂可供选择:
| A.氯水 | B.H2O2 | C.NaOH | D.Cu2(OH)2CO3 |

(5)用试剂编号表示:试剂l为_____________,试剂2为_____________。
(6)为什么先“氧化”后“调节pH”?pH控制范围为多少?__________________________________
下列方法中,不能用于实验室里制取氨气的是( )
| A.加热烧瓶中的浓氨水 |
| B.加热试管中的熟石灰和氯化铵固体的混合物 |
| C.将分液漏斗中的浓氨水滴入装有生石灰的烧瓶中 |
| D.加热试管中的氯化铵固体,并将产生的气体通过装有碱石灰的干燥管 |