题目内容
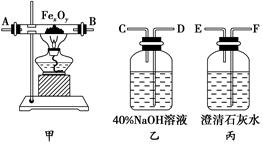
一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液。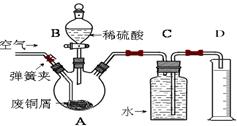
(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭。①此时装置C中产生的现象是 。
②反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体,则该废铜屑中铜的质量百分含量为 。
(2)接下来使Cu完全溶解的操作是:
① 拆除C、D装置后,打开弹簧夹
②____________________________________________________________________
(3)为使A中固体加快溶解速率,以下方法运用合理的是 。
a.对A装置加热;b.向A内加入少量Fe2O3;c.向A内加入少量CuO;d.增大空气通入量;e.向A内加入少量FeSO4;f.向A内加入少量H2O
(4)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁元素被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液。
①此过程的离子反应方程式是 。
②检验溶液中铁元素是否被完全沉淀最好的方法是___________
a.取样于试管→滴加KSCN溶液
b.取样于试管→滴加酸性KMnO4溶液
c.取样于试管→纸上层析后→ 喷KSCN溶液;
(5)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,其具体操作步骤可续写为: 。
(1)①水面下降,水顺长导管排入D中 (2分) ②88.8% (2分)
(2)②持续将空气通入A中,至A中固体全部消失,(2分)再继续通入一段时间空气后,关闭弹簧夹,停止通入空气。(2分)
(3)a b d e (2分)
(4)①Cu2(OH)2CO3 + H+ + Fe3+ = 2Cu2+ + Fe(OH)3↓ + CO2↑(2分) ②c (2分)
(5)将(4)中所得红褐色沉淀洗涤、干燥、称量、计算(2分)
解析试题分析:(1)①A中的废铜屑含有铁加入稀硫酸反应生成氢气,装置C是排水量气装置,现象是C中液面下降,水被排到D中;
②10g废铜屑样品,反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体为氢气物质的量为0.02mol,Fe+H2SO4=FeSO4+H2↑,铁物质的量为0.02mol,质量为0.02mol×56g/mol=1.12g,该废铜屑中铜的质量百分含量=(10g?1.12g)/10g×100%=88.8%;
(2)拆除C、D装置后,打开弹簧夹,持续将空气通入A中,铁和硫酸反应生成的亚硫酸亚铁会被空气中的氧气氧化为硫酸铁,铁离子具有氧化性能氧化溶解铜,至A中固体全部;消失反应的离子方程式为:4Fe2++O2 +4H+=4Fe3++2H2O,2Fe3++Cu=2Fe2++Cu2+,再继续通入一段时间空气后,关闭弹簧夹,停止通入空气.
(3)为使A中固体加快溶解速率:
a.对A装置加热,会加快反应速率,故a正确;
b.向A内加入少量Fe2O3,溶解后自动铁离子浓度会提高溶解铜的反应速率,故b正确;
c.向A内加入少量CuO,和硫酸反应不能加快溶解速率,故c错误;
d.增大空气通入量,自动氧气浓度可以提高反应速率,故d正确;
e.向A内加入少量FeSO4,增大了亚铁离子浓度能加快反应速率,故e正确;
f.向A内加入少量H2O,稀释溶液浓度,反应速率减小,故f错误;
故选abde;
(4)①将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,此过程离子反应方程式是:
Cu2(OH)2CO3+H++Fe3+=2Cu2++Fe(OH)3↓+CO2↑
②因为前面铁元素都是Fe3+ ,所以要检验是否被完全沉淀,可以加入KSCN溶液进行检验,若,没有红色现象则说明铁元素被沉淀完全。
(5)不用测量气体法,可以依据沉淀方法,测定沉淀氢氧化铁质量,计算铁元素质量,得到铜的质量,计算废铜屑中铜的质量百分含量,沉淀实验方法为:得到的氢氧化铁沉淀洗涤、干燥、称量、计算.
考点:本题考查的是物质性质的探究实验方法和实验设计。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验。
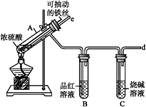
图1 图2
(1)比较两实验装置,图2装置的优点是:
①能更好地吸收有毒气体SO2,防止其污染环境;
② 。
(2)导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻止SO2气体逸出而污染环境;二是 。
(3)能说明有SO2气体产生的实验现象是 。
(4)反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有以下三种可能:
Ⅰ:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+。
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
| A.稀HCl溶液 | B.稀H2SO4溶液 | C.KSCN溶液 | D.KMnO4溶液 |
验证Ⅱ:取试样,先滴加少量的 (填试剂序号,下同),振荡,再滴加少量的 ,根据溶液颜色的变化可确定假设Ⅱ是否正确。反应的离子方程式是 ,Fe3++3SCN-
 Fe(SCN)3。
Fe(SCN)3。 验证Ⅲ:步骤1.取试样,滴加少量的 (填试剂序号),溶液的颜色变 色,则试样中含有Fe3+。
步骤2.再取适量的试样滴加到少量的 (填试剂序号),观察到的现象为 ,则试样中含有Fe2+。
为测定Na2CO3和NaHCO3固体混合物中Na2CO3的质量分数,称取一定质量的样品,甲同学利用图I所示装置测量产生CO2的体积,乙同学利用图II所示装置通过干燥管的增重测量产生CO2的质量,已知所用稀硫酸均足量。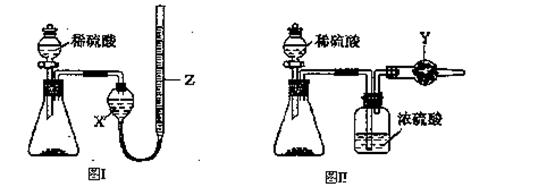
(l)盛放稀硫酸的仪器名称为 ;
(2)试剂X为 ,试剂Y为 ;
(3)甲同学在进行实验时,为减小误差,应注意的事项有(填选项字母) ;
| A.读数前应使整套装置冷却至室温 |
| B.调整Z的高度使量气装置左右液面相平 |
| C.读数时视线与Z内凹液面最低点相切 |
| D.读数前应通入一定量的N2使生成的CO2全部进入量气装置 |
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
I、经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水 FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下: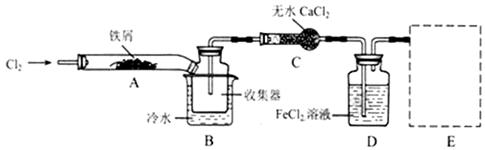
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(3)如果没有装置C的设计,会导致
(4)用离子方程式表示虚线框E中所增加装置和试剂的作用: 。
(5)用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,请写出反应的离子方程式: 。
Ⅱ、反应结束后,将收集器中所得固体完全溶于稀盐酸,小组同学对所得溶液金属阳离子的成分有三种观点:①只有Fe3+;②只有Fe2+;③ 。
为探究溶液的组成,实验如下:
| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液。 | _________________。 | 说明:假设②不成立,假设①或③成立;反应的离子方程式是_____________。 |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液。 | 溶液紫红色退去 | 说明:________________________。 |
综合上述实验分析,所得溶液中含有的金属阳离子有 。
某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质R,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设A:该固体物质是FeCl3;
假设B:__________________________________________________________;
假设C:__________________________________________________________。
(2)设计实验方案:
取少量固体物质R于烧杯中,加适量水溶解,然后取两份R溶液分别进行实验,实验现象与结论如下表,请在表格内填写实验现象:
| 实验方法 | 实验现象 | 结论 |
| ①向R溶液中 加KSCN溶液 | | 固体物质中有FeCl3 |
| ②向R溶液中滴加 酸性KMnO4溶液 | | 固体物质中不含FeCl2 |
由此得出结论:假设________成立(填字母)。
(3)写出向R溶液中滴加少量KSCN溶液的离子方程式: 。25°C时,测得该反应达平衡时的平衡常数为K1,保持温度不变,继续滴加少量KSCN溶液,达新平衡时,测得平衡常数为K2,则K1 K2(填“>”,“<”或“=”),溶液的颜色 (填“变深”,“变浅”或“不变”)。
(4)R溶液常作印刷电路铜板的腐蚀剂,写出该反应的离子方程式:___________________________。