题目内容
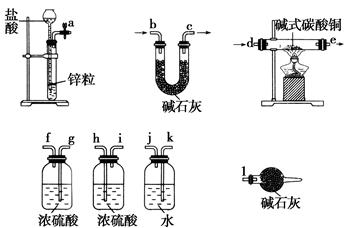
某研究性学习小组在网上收集到信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入盛满CO2的集气瓶中,钠在 其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘 附着白色物质。
(1)通过钠在CO2气体中燃烧的实验,你认为燃烧的条件是:
_________________________________________________________________。
(2)燃烧的本质是:_____________________________________________。
(3)2010年8月初发生的俄罗斯森林大火着火面积比伦敦市的面积还要大。控制森林火灾是世界性难题。根据燃烧的条件,请你解释为什么设置森林防火隔离带能有效阻止森林火灾的蔓延:_____________________________________________________________。
【提出假设】
假设1:白色物质是Na2O
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物
【设计实验方案·验证假设】该小组对燃烧后的白色产物进行如下探究:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
【思考与交流】
(4)甲同学认为方案1得到的结论不正确,其理由是:___________________________________
(5)乙同学认为方案2得到的结论正确,白色物质为:________。
(6)通过方案1和方案2的实验,你认为上述三个假设中,________成立。你的理由是:_____________________________________________________。
(7)钠在二氧化碳中燃烧的化学方程式为:____________________________
(8)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由:
________________________________________________________
(1)要有可燃物;要有助燃物;可燃物的温度必须达到着火点
(2)发光发热的剧烈的氧化还原反应
(3)消除了可燃物的存在
(4)Na2CO3溶液显碱性,也会使酚酞变红
(5)Na2CO3
(6)假设2 方案2的①中出现的白色沉淀说明有CO32—,②中加酚酞无明显现象说明无Na2O
(7)4Na+3CO2 2Na2CO3+C
2Na2CO3+C
(8)不同意,因为反应体系中无氢元素(或其他合理答案)
解析

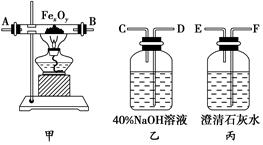
三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者的混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设
假设1:红色粉末是Fe2O3
假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验
取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是_____________________________________________。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?________。简述你的理由(不需写出反应方程式)____________
________________________________________________________________________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是________,写出发生反应的离子方程式________________________________。
探究延伸
经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数,取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为________。
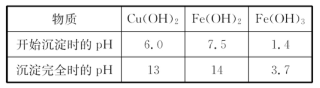
(5)实验小组欲利用该红色粉末制取较纯净的胆矾(CuSO4·5H2O)。经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
实验室有下列试剂可供选择:A.氯水 B.H2O2 C.NaOH D.Cu2(OH)2CO3
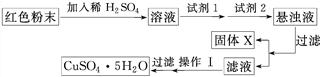
实验小组设计如下实验方案:
试回答:
①试剂1为________(填字母,后同),试剂2为________。
②固体X的化学式为____________________________________________________。
③操作Ⅰ为___________________________________________________________。
铁是人类必需的微量元素之一,它可以促进血红蛋白结合氧分子进行输氧,医学上经常用硫酸亚铁糖衣片给患贫血的病人补铁.请根据以下药品说明书回答问题:
(1)药片上的糖衣可以起__________的作用,鉴定时溶解加盐酸的目的是____________。
(2)某研究小组甲欲用KMnO4测定FeSO4的含量。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250毫升,配制时需要的仪器除托盘天平、烧杯、玻璃棒、量筒外,还需要的仪器有__________、___________。
②滴定时含硫酸亚铁的滤液放在___________(填仪器)中,高锰酸钾溶液放在__________(填仪器)中,滴定时加入___________(填“酚酞”或“甲基橙”或“石蕊”或“不用加”)指示剂,如何判断达到滴定终点_____________。
(3)另一研究小组乙设计了如下测量方案: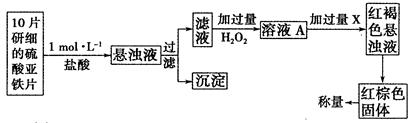
①此检验过程中加过量H2O2反应的离子方程式为______________。
②从红褐色的悬浊液到最后的称量,其过程中所需的基本操作有___________(按操作的顺序填写)。
| A.过滤 | B.洗涤 | C.萃取 | D.分液 E.冷却 F.灼烧 |
 (x+y)Cu+xCO2+(x+2y+z)H2O
(x+y)Cu+xCO2+(x+2y+z)H2O