题目内容
14.一块表面被氧化为Na2O的钠块10.8g,投入到100g水中完全反应,收集到H22.24L(标准状况),试求:(1)钠块中未被氧化的钠的质量;
(2)所得溶液的溶质的质量分数;
(3)若将所得溶液稀释为1000mL,则稀释后溶液中溶质的物质的量浓度.
分析 (1)Na和水反应生成H2,Na2O和水反应生成NaOH,根据转移电子守恒计算未被氧化的钠的质量;
(2)根据钠原子守恒计算生成m(NaOH),溶液质量=10.8g+100g-$\frac{2.24L}{22.4L/mol}×2g/mol$=110.6g.
溶液质量分数=$\frac{溶质质量}{溶液质量}×100%$;
(3)根据c=$\frac{n}{V}$计算稀释后溶液物质的量浓度.
解答 解:(1)Na和水反应生成H2,Na2O和水反应生成NaOH,根据转移电子守恒得未被氧化的钠的质量=$\frac{\frac{2.24L}{22.4L/mol}×2}{1}×23g/mol$=4.6g,
答:未被氧化的钠的质量是4.6g;
(2)n(Na2O)=$\frac{10.8g-4.6g}{62g/mol}$=0.1mol,根据Na原子守恒得n(NaOH)=n(Na)+2n(Na2O)=$\frac{4.6g}{23g/mol}$+2×0.1mol=0.4mol,m(NaOH)=40g/mol×0.4mol=16g,溶液质量=10.8g+100g-$\frac{2.24L}{22.4L/mol}×2g/mol$=110.6g,
溶液质量分数=$\frac{溶质质量}{溶液质量}×100%$=$\frac{16g}{110.6g}×100%$=14.47%,
答:所得溶液的质量分数14.47%;
(3)c(NaOH)=$\frac{n}{V}$=$\frac{0.4mol}{1L}$=0.4mol/L,
答:所得溶液的物质的量浓度是0.4mol/L.
点评 本题考查化学方程式的有关计算,为高频考点,侧重考查学生分析计算能力,注意原子守恒的灵活运用,注意溶液质量的计算方法,为易错点.

 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案| A. | ④②⑤①③ | B. | ②④⑤①③ | C. | ④⑤②①③ | D. | ⑤②④①③ |
| A. | CO | B. | H2 | C. | CO2 | D. | Cl2 |
| A. | K+、H+、Cl-、CO32- | B. | K+、Cu2+、SO42-、NO${\;}_{3}^{-}$ | ||
| C. | H+、Na+、OH-、Cl- | D. | Mg2+、Al3+、OH-、SO42- |
| A. | 稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 | |
| B. | 将SO2和Cl2按等物质的量比例通入品红溶液中,品红很快褪色 | |
| C. | NO2和H2O反应过程中,被氧化的氮原子与被还原的氮原子个数比为2:1 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
| A. | NH4NO3 | B. | NaCl | C. | H2SO4 | D. | H2O |
| A. | 64g | B. | 64 | C. | 64 g/mol | D. | 32 g/mol |
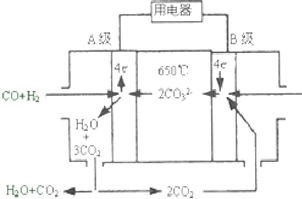 熔融碳酸盐燃料电池(MCFS),发明于1889年.现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示.请回答下列问题:
熔融碳酸盐燃料电池(MCFS),发明于1889年.现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1:1)直接作燃料,其工作原理如图所示.请回答下列问题: